
科目: 来源: 题型:
【题目】现有反应PCl5(g)![]() PCl3(g)+Cl2(g),523K时,将10mol PCl5注入容积为2L的密闭容器中,平衡时压强为原来的1.5倍。
PCl3(g)+Cl2(g),523K时,将10mol PCl5注入容积为2L的密闭容器中,平衡时压强为原来的1.5倍。
(1)该温度下该反应的平衡常数K为________
(2)PCl5的平衡转化率为________
查看答案和解析>>
科目: 来源: 题型:
【题目】白磷在氧气中燃烧的反应为:P4 + 5O2 = P4O10。已知下列化学键的键能分别为:P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据,下列推断正确的是

A.6a+5d < 4c + 10b
B.△H = (4c+12b-6a-5d) kJ·mol-1
C.6a+5d > 4c + 12b
D.△H = (6a+5d-4c-12b) kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】利用钛白工业的副产品FeSO4(含TiO2+、Al3+)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:

已知:
①过滤1得到的滤渣的主要成分是Al(OH)3、H2TiO3。
②5Fe2++ MnO4-+8H+=5Fe3+ +Mn2++4H2O
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有_____。
(2)沉淀反应的离子方程式是______________。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入30 mL 2 mol·L-1的H2SO4溶解。
步骤2:用0.2000 mol·L-1标准KMnO4溶液滴定,消耗其体积31.60 mL。
步骤3:向滴定后的溶液中加入3g Zn粉和8 mL 2 mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00 mL。
则样品中C2O42-的物质的量为______。(写出计算过程)
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如下图,其变化趋势的原因可能为________。

查看答案和解析>>
科目: 来源: 题型:
【题目】锰元素的化合物在多个领域中均有重要应用。
(1)Mn2+基态核外电子排布式为________,SO42-中S原子轨道的杂化类型为________。
(2)二价锰的3种离子化合物的熔点如下表:
物质 | MnCl2 | MnS | MnO |
熔点 | 650℃ | 1610℃ | 2800℃ |
上表3种物质中晶格能最大的是________。
(3)某锰氧化物的晶胞结构如图所示,该氧化物的化学式为________。
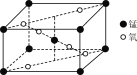
(4)在化合物K3[Mn(CN)6]中,微粒之间存在的作用力有________(填字母)。
a. 离子键 b. 共价键 c. 配位键 d. 氢键
(5)制备LiMn2O4的实验过程如下:将MnO2和Li2CO3按4∶1的物质的量之比配料,球磨3~5 h,然后升温,高温加热,保温24 h,冷却至室温。写出该反应的化学方程式:____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】图中,A是单质,B的焰色反应呈黄色。判断A、B、C、D的化学式:

A_____ B______ C______ D______
下列转化的化学方程式为:
(1)A→B__________
(2)B→D________
(3)A→C__________
查看答案和解析>>
科目: 来源: 题型:
【题目】废水中氨态氮以NH3H2O、NH3和NH4+的形式存在,废水脱氮已成为主要污染物减排和水体富营养化防治的研究热点。
Ⅰ.沉淀法
向废水中投入MgCl2和Na2HPO4,生成MgNH4PO46H2O沉淀,可将氨态氮含量降至10mg·L1以下。
(1)NH3的电子式:______。
(2)废水中的NH3H2O转化为MgNH4PO46H2O的离子方程式是______。

(3)16℃时,向废水中加入MgCl2和Na2HPO4,使镁、氮、磷物质的量之比为1︰1︰1,沉淀过程中的pH对剩余氨态氮浓度的影响如图。欲使剩余氨态氮浓度低于10mg·L1,pH的适宜范围是______,pH偏大或者偏小均不利于MgNH4PO46H2O的生成,原因是______。
Ⅱ.微波—氧化法
(4)仅对废水进行微波加热,pH对氨态氮脱出的影响如下表。
溶液pH | 6~7 | 8~9 | 10~11 | 11~12 |
剩余氨态氮浓度(mg·L1) | 156 | 100 | 40 | 14 |
表中数据表明:pH增大有利于废水中化学平衡______(用化学用语表示)的移动。
(5)微波协同CuO和H2O2除去氨态氮
①其他条件相同,取相同体积的同一废水样品,微波10min,剩余氨态氮浓度与一定浓度H2O2溶液添加量的关系如下图。据图推测CuO在氨态氮脱除中可能起催化作用,理由是______。

②微波协同CuO有利于H2O2除去氨态氮。该条件下,H2O2将NH3氧化为N2的化学方程式是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有以下物质:①NaHSO4晶体,②液态O2 ,③冰醋酸(固态醋酸), ④汞,⑤BaSO4固体,⑥Fe(OH)3 胶体,⑦酒精(C2H5OH) ,⑧熔化KNO3,⑨盐酸,⑩金属钠,请回答下列问题(用序号):
(1)以上物质中能导电的是__________
(2)以上物质属于电解质的是_____________
(3)以上物质中属于非电解质的是_______
(4)请写出①在熔融状态下的电离方程式________________
(5)a. 写出制备⑥的实验操作为_________;
b. 制备⑥的离子方程式为____________________,
c. 在制得的⑥中逐滴加入稀硫酸的实验现象为_____________________________。
(6)写出⑩在加热条件下与氧气反应的化学方程式________________________。若将2.3克钠放入97.7克水中,生成的溶液中溶质的质量分数_________(填“大于”、“小于” 或“等于”)2.3%。
(7)标准状况下,CO与CO2相对于②的密度为1,则混合气体中CO与CO2的比例为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制取并收集氯气的装置如图所示,请回答下列问题
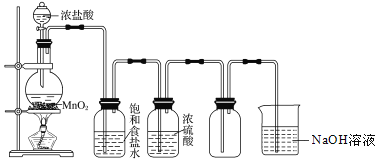
(1)气体发生装置中进行的反应化学方程式是______。
(2)在装置中:①饱和食盐水的作用是______,②浓硫酸的作用是______。
(3)化学实验中检验是否有![]() 产生常用湿润的淀粉
产生常用湿润的淀粉![]() 试纸
试纸![]() 如果有
如果有![]() 产生,可观察到的现象是______。
产生,可观察到的现象是______。
(4)写出尾气吸收装置中进行的反应的离子方程式______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. Fe(OH)3和HI的反应 Fe(OH)3+3H+==Fe3++3H2O
B. 1.5 mol/L 100 ml的FeBr2溶液中通入3.36L(标准状况)Cl2:2Fe2++2Br-+2Cl2==2Fe3++4Cl-+Br2
C. 铁与足量的稀硝酸溶液反应放出NO气体:3Fe+8H++2NO3-==3Fe2++4H2O+2NO↑
D. 向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH-==2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。

(1)除如图装置所示的实验用品外,还需要的一件实验用品是______________。
(2)圆底烧瓶中所发生反应的离子方程式为___________。
(3)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是____________________________________。
(4)利用该化学反应,试简述测定反应速率的其他方法:________________(写一种)。
Ⅱ.探究化学反应速率的影响因素
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表。(已知 I2+2 Na2S2O3=== Na2S4O6+2 NaI,其中Na2S2O3溶液均足量)
实验序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | T1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | T2 |
③ | 6.0 | 2.0 | 4.0 | Vx | T3 |
(5)表中Vx=__________mL,T1、T2、T3的大小关系是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com