
科目: 来源: 题型:
【题目】下列物质既不能使溴水褪色,又不能使酸性高锰酸钾溶液褪色的是
①乙烷 ②乙烯 ③乙炔 ④苯 ⑤甲苯 ⑥溴乙烷 ⑦聚丙烯 ⑧环己烯
A. ①②③⑤ B. ①④⑥ C. ①④⑥⑦ D. ②③⑤⑧
查看答案和解析>>
科目: 来源: 题型:
【题目】在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g)![]() 4NO2(g)+ O2(g)。反应5min后,测得N2O5转化了20%,求:
4NO2(g)+ O2(g)。反应5min后,测得N2O5转化了20%,求:
(1)υ(NO2)、υ(O2)分别为多少?
(2)5min时,N2O5占混合气体总体积的百分比是多少?
(要求写出计算过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:AgBr比AgCl更难溶,将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,发生的反应为
A. 只有AgBr沉淀生成 B. AgCl与AgBr沉淀等量生成
C. AgCl与AgBr沉淀都有,但以AgCl沉淀为主 D. AgCl与AgBr沉淀都有,但以AgBr沉淀为主
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,在20mL,0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是

A. 在C点:c(CH3COO-)﹥c(Na+)﹥c(H+) ﹥c(OH-)
B. 在C点:c(CH3COO-)+c(CH3COOH)﹦2 c(Na+)
C. 在B点:c(OH-)﹦c(H+),c(Na+)﹦c(CH3COO-)
D. 在A点:c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】在T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示。下列说法中不正确的是( )

A.T ℃时,在Y点和Z点,Ag2CrO4的Ksp相等
B.向饱和Ag2CrO4溶液中加入固体K2CrO4不能使溶液由Y点变为X点
C.T ℃时,Ag2CrO4的Ksp为1×10-8
D.图中a=×10-4
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素X、Y、Z在周期表中位置关系如图所示。
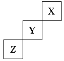
(1)X元素的单质分子式是___。若X核内中子数与质子数相等,X单质的摩尔质量是___。
(2)Y单质的电子式是___。
Y单质与水反应的化学方程式:___。
Z与钠形成的化合物的电子式是:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用铁及其化合物的有关知识,回答下列问题:
(1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是________。
A.纯铁硬度比生铁高 B.纯铁耐腐蚀性强,不易生锈
C.不锈钢是铁合金,只含金属元素 D.铁在一定条件下,可与水蒸气反应
E.铁在冷的浓硫酸中钝化
(2)向沸水中逐滴滴加1 mol·L-1 FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为______________________________________________________
形成该分散系的微粒直径范围是_________________________________。
(3)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出 FeCl3溶液与铜反应的离子方程式________________________________________________。
欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液,现有下列试剂:①氯气,②铁粉,③浓硝酸,④浓盐酸,⑤烧碱,⑥浓氨水,需要用到的一组试剂是________。
A.①②④ B.①③④⑥ C.②④⑤ D.①④⑥
(4)高铁酸钠Na2FeO4 是一种新型净水剂。
①高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH===2Na2FeO4+3X+5H2O,则X的化学式为____________。
②下列物质能作水处理剂的有________。
A.KAl(SO4)2·12H2O B.[Fe(OH)(SO4)]n C.ClO2 D.“84”消毒液
③请写出向酸化的FeCl2溶液中滴加双氧水的离子方程式__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图如图,B元素最外层电子数是次外层电子数的四分之一,C元素的气态氢化物的水溶液显碱性,据此填空:

(1)A元素气态氢化物的电子式___,A、B、C、D四种元素按原子半径由大到小的顺序排列为___。(填元素符号)
(2)A的最高价氧化物与氢氧化钠反应的离子方程式为___。
(3)A,C,D的最高价氧化物对应水化物的酸性强弱_______,C的氢化物比D的氢化物沸点___(填“高”或“低”),原因是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D四种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C。
(1)B元素的名称___;B在周期表中的位置第___周期,第___族;
(2)A、B形成的化合物的电子式___;
(3)C的最高价氧化物的化学式___;
(4)D2C的电子式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】铝土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料。提取氧化铝的工艺流程如下:

(1)滤液甲的主要成分是(写化学式___________________________________________。
(2)写出反应Ⅱ的离子方程式:______________________________________________。
(3)结合反应Ⅱ,判断下列微粒结合质子(H+)的能力,由强到弱的顺序是__________(填字母)。
A.AlO![]() B.OH- C.SiO
B.OH- C.SiO![]()
(4)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀消失。沉淀消失的原因可用离子方程式表示为________________________________________________________________________。
(5)取(4)电解以后的溶液10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol·L-1盐酸溶液,当加入50.0 mL盐酸溶液时,生成的沉淀恰好溶解。
加入50.0 mL盐酸溶液发生的离子反应的先后顺序依次为:____________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com