
科目: 来源: 题型:
【题目】下列有关铜的化合物说法正确的是( )
A. 根据铁比铜金属性强,在实际应用中可用FeCl3腐蚀Cu刻制印刷电路板
B. CuSO4溶液与H2S溶液反应的离子方程式为:Cu2++S2-![]() CuS↓
CuS↓
C. 用稀盐酸除去铜锈的离子方程式为CuO+2H+===Cu2++H2O
D. 化学反应:CuO+CO![]() Cu+CO2的实验现象为黑色固体变成红色固体
Cu+CO2的实验现象为黑色固体变成红色固体
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化铈CeO2是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末含(SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。

已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液
(1)稀酸A的分子式是_____________________。
(2)滤液1中加入H2O2溶液的目的是____________________。滤渣1中加入稀酸A和H2O2发生反应的离子方程是为______________________。
(3)某同学设计实验证明滤液1中含有Fe2+,他所用的试剂的化学式为______________。
(4)己知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,请书写该反应的离子方程式__________________________________。
(5)由滤液2生成Ce(OH)4的离子方程式___________________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,请用离子方程式解释其作用原理:___________________________ 。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.1000mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质量分数为___________________(结果保留两位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.某单烯烃与H2 加成后的产物为(C2H5)2CHCH2C(CH3)3,则该烯烃可能的结构简式有5种
B. 有机物的名称是2,4,4-三甲基戊烷
有机物的名称是2,4,4-三甲基戊烷
C.甲苯与氯气在光照下反应主要生成2,4,6-三氯甲苯
D.沼气、油田气和可燃冰中均含有甲烷
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.标况下2.24L的苯完全燃烧生成CO2的分子数目为0.6NA
B.7.8gNa2S和Na2O2的混合物中,含有的阴离子数目为0.3NA个
C.18g的D2O含有的中子数目均为10NA
D.42g的C2H4与C3H6的混合物中含有的共价键数目为9 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向NaHS溶液中滴入酚酞 | 溶液变红色 | HS-水解程度大于电离程度 |
B | 向浓度均为0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
C | 向Na2CO3溶液中加入浓盐酸,将产生的气体通入硅酸钠溶液中 | 产生白色浑浊 | 酸性:盐酸>碳酸>硅酸 |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在I |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】用某铜矿(含CuS以及少量FeO和Fe2O3)制备CuCl的主要流程如下:
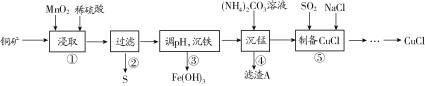
已知Fe3+、Mn2+、Cu2+生成氢氧化物沉淀时的pH如下表所示:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Mn(OH)2 | 7.1 | 10.1 |
Cu(OH)2 | 4.7 | 6.7 |
(1)浸取时,CuS被浸取的离子方程式为CuS+MnO2+4H+=Cu2++Mn2++S↓+2H2O,该反应的氧化剂是________(填化学式),Fe2O3被浸取的离子方程式为________________。
(2)步骤③调整pH的范围为______,滤渣A的成分为________(填化学式)。
(3)“沉铁”时,需要检验Fe3+是否沉淀完全,所用的试剂为________(填化学式)。
(4)准确称取所制备的氯化亚铜样品1.600 g,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用0.100 0 mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液25.00 mL,反应中Cr2O72-被还原为Cr3+,计算样品中CuCl的质量分数(写出计算过程)______。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的流程如下:

下列说法错误的是( )
A. 向大气中排放SO2可能导致酸雨发生
B. 中和器中发生反应的离子方程式为HSO3-+OH-= SO32-+H2O
C. 检验Na2SO3成品中是否含Na2SO4,可选用稀盐酸和Ba(NO3)2溶液
D. 进入离心机的分散系是悬浊液
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组探究石蜡油分解产物,设计了如图实验方案。下列说法错误的是
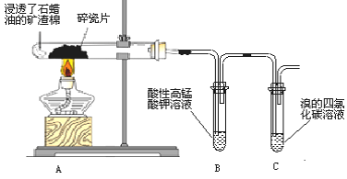
A.碎瓷片有催化和积蓄热量的作用
B.点燃C 出口处,火焰明亮,伴有黑烟
C.B、C 中溶液均褪色,反应类型相同
D.结束反应时,先撤出导管,再停止加热
查看答案和解析>>
科目: 来源: 题型:
【题目】在如图所示的物质转化关系中,A、H为常见的金属单质,其中A为紫红色金属;D、F为气体,其中F为黄绿色气体;B、G为两种常见的酸;由J生成I的反应是电子工业常用的反应。(部分生成物和反应条件未列出)
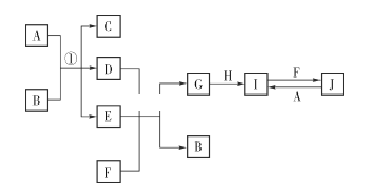
请回答下列问题:
(1)F的电子式为 ____________ 。
(2)G的化学式为 ____________。
(3)写出反应①的化学方程式:______________________________________________
(4)写出由J生成I的离子方程式:______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要村料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是____________(填标号)。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是__________、__________。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是__________,其中与乙二胺形成的化合物稳定性相对较高的是__________(填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如下表所示:
氧化物 | Li2O | MgO | P4O6 | SO2 |
熔点/°C | 1570 | 2800 | 23.8 | 75.5 |
解释表中氧化物之间熔点差异的原因__________。
(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=__________pm,Mg原子之间最短距离y=__________pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是__________g·cm3(列出计算表达式)。


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com