
科目: 来源: 题型:
【题目】现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,求原溶液中Mg2+与Al3+的物质的量之比为( )

A.2:1B.6:1
C.1:2D.1:3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列诗句、谚语或与化学现象有关,说法不正确的是
A. “水乳交融,火上浇油”前者包含物理变化,而后者包含化学变化
B. “落汤螃蟹着红袍”肯定发生了化学变化
C. “滴水石穿、绳锯木断”不包含化学变化
D. “看似风平浪静,实则暗流涌动”形象地描述了溶解平衡的状态
查看答案和解析>>
科目: 来源: 题型:
【题目】采用乙烯与甲苯为主要原料,按下列路线可合成有机物 E、F:
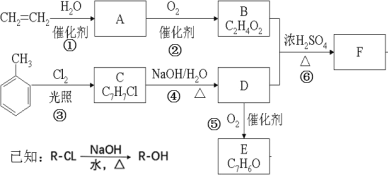
请回答:
(1)B 中官能团的名称是_________,反应⑥的反应类型是__________。
(2)D→E 的 化 学 方 程 式_________________________________。
(3)F 的 结 构 简 式___________________________。
(4)下列有关说法不正确的是_________。
A.E 能与新制的 Cu(OH)2 悬浊液发生反应,而 B 不能与新制的 Cu(OH)2 悬浊液发生反应
B.F 在碱性条件下可发生皂化反应
C. ![]() 不能使酸性 KMnO4 溶液褪色
不能使酸性 KMnO4 溶液褪色
D. 1mol E 和足量 H2 反应,最多消耗 4mol H2
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中的还原剂是____,每生成l mol Na2FeO4转移__mol电子。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO﹣、OH﹣、FeO42﹣、Cl﹣、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:________。
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为______mol。
(3)将SO2通入含1mol氯酸的溶液中,可生成一种强酸和一种氧化物,并有6.02×1023个电子转移,则该反应的化学方程式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学用一种铝铁合金为原料,模拟相关的工业生产,反应过程如图所示(部分产物和条件已略去),请回答:

(1)铁铝合金是一种高电磁性能合金,下列有关推测可能正确的是_____(填序号).
A.铁铝合金可由铁和铝熔融混合制成
B.铁铝合金的熔点高于铝和铁
C.铁铝合金硬度高于纯铝
(2)反应①中铝元素发生反应的离子方程式为_______________________。
(3)反应②的化学方程式为____________________________________。
(4)反应③发生时观察到的现象是_____________________________,用化学方程式表示颜色变化的原因_____________________________________。
(5)反应④中的CO2不宜换成HCl,原因是_____________________。
(6)请举出固体A一种用途_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】丁酸乙酯广泛应用于食用香精配方中,可调配多种果香型香精。实验室制备丁酸乙酯的反应、装置示意图(如图)和有关数据如下:
密度/(g/cm3) | 沸点/℃ | 水中溶解性 | |
正丁酸 | 0.9587 | 163 | 溶 |
丁酸乙酯 | 0.877 | 121 | 难溶 |

实验步骤:在A中加入10.0g的乙醇、8.80g的丁酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集120~123℃馏分,得丁酸乙酯4.80g。
回答下列问题:
(1)仪器B中,冷凝水从_____(填“a”或“b”)口进。
(2)在洗涤操作中,第一次水洗的主要目的是____,饱和碳酸氢钠溶液的作用是____,第二次水洗的主要目的是_____。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后____(填序号)。
a.直接将丁酸乙酯从分液漏斗的上口倒出
b.先将水层从分液漏斗的下口放出,再将丁酸乙酯从下口放出
c.直接将丁酸乙酯从分液漏斗的下口放出
d.先将水层从分液漏斗的下口放出,再将丁酸乙酸从上口倒出
(4)实验中加入过量乙醇的目的是_________。
(5)实验中加入少量无水MgSO4的目的是________。
(6)本实验的产率是____(保留三位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳元素及其化合物与人类的生活、生产息息相关,请回答下列问题:
(1)绿色植物的光合作用吸收 CO2 释放O2 的过程可以描述为以下两步: 2CO2(g)+2H2O(l)+2C5H10O4(s) = 4(C3H6O3)(s)+O2(g)+4e- △H=+1360 kJ·mol-1
12(C3H6O3)(s)+12e- = C6H12O6(s,葡萄糖)+6C5H10O4(s)+3O2(g) △H=-1200 kJ·mol-1
则绿色植物利用二氧化碳和水合成葡萄糖并放出氧气的热化学方程式为:___________。
(2)工业炼铁时有如下副反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g) △H>0。某温度时,把 Fe 和CO2 放入体积固定的容器中,CO2 的起始浓度为 2.0 molL-1,达到平衡后,CO 的浓度为 1.0 molL-1,则该温度下,该反应的平衡常数 K=_________。如果平衡后通入一定量的 CO,建立新平衡后,CO2 的物质的量分数将________。(填编号)
FeO(s)+CO(g) △H>0。某温度时,把 Fe 和CO2 放入体积固定的容器中,CO2 的起始浓度为 2.0 molL-1,达到平衡后,CO 的浓度为 1.0 molL-1,则该温度下,该反应的平衡常数 K=_________。如果平衡后通入一定量的 CO,建立新平衡后,CO2 的物质的量分数将________。(填编号)
A.增大 B.减少 C.不变 D.无法判定
(3)利用 H2 和 CO2 在一定条件下可以合成乙烯:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)。在体积为 1L 的恒容容器中,投料为 3mol H2 和 1mol CO2 时,不同温度对 CO2 的平衡转化率及催化剂的催化效率的影响如下图所示。
CH2=CH2(g)+4H2O(g)。在体积为 1L 的恒容容器中,投料为 3mol H2 和 1mol CO2 时,不同温度对 CO2 的平衡转化率及催化剂的催化效率的影响如下图所示。
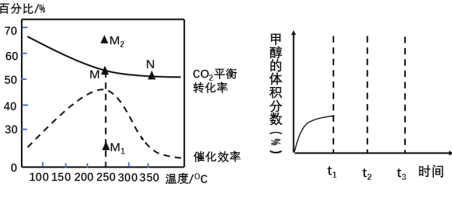
下列有关说法不正确.的是______(填序号)。
A.平衡常数大小:M>N
B.反应物活化分子百分数大小:M>N
C.其他条件不变,若不使用催化剂,则 250℃时 CO2 的平衡转化率可能位于点M1
D.其他条件不变,若投料改为 4mol H2 和 1mol CO2 时,则 250℃时 CO2 的平衡转化率可能位于点M2
(4)将 CO2 与 H2 按物质的量之比为 1:3 通入恒温恒容密闭容器中,控制条件,使其发生反应: CO2 (g)+3H 2(g) ![]() CH3 OH(g)+H2 O(g) △H = -49.2kJ·mol-1,得到甲醇的体积分数与时间的关系如上图所示。保持其它条件不变,t1 时再向容器中加入一定量物质的量之比为 1:3 的 CO2 与 H2 混合气,t2 时再次达到平衡,请在上图画出 t1~t3 时间内甲醇体积分数随时间的变化曲线。 ___________
CH3 OH(g)+H2 O(g) △H = -49.2kJ·mol-1,得到甲醇的体积分数与时间的关系如上图所示。保持其它条件不变,t1 时再向容器中加入一定量物质的量之比为 1:3 的 CO2 与 H2 混合气,t2 时再次达到平衡,请在上图画出 t1~t3 时间内甲醇体积分数随时间的变化曲线。 ___________
(5)以多孔石墨为阳极,以 NaCl 和 NaOH 的混合溶液作电解液,用电解法由甲烷制取甲醇。写 出 阳 极 的 电 极 反 应 式 :_________。
(6)25℃时,将 a molL-1 的 CH3COOH 溶液与 b molL-1 的 NaOH 溶液等体积混合,溶液恰好呈中性, 则电离平衡常数Ka(CH3COOH)=__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硼氢化钠(NaBH4)在化工领域具有重要的应用价值,可采用硼砂、SiO2、Na和H2作为原料制备。回答下列问题:
(1)周期表中,与B的化学性质最相似的邻族元素是____;该元素基态原子核外M层电子中自旋状态相同的有_____个。
(2)NaBH4中,电负性最大的元素是____(填元素符号);B的____杂化轨道与H的1s轨道形成![]() 键。
键。
(3)硼砂是含8个结晶水的四硼酸钠。其阴离子(含B、O、H三种元素)的球模型如图所示:
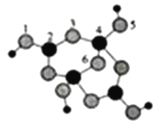
①阴离子中,配位键存在于____和____原子之间。(均填原子的序号)
②硼砂的化学式为_______。
(4)SiO2晶胞(立方体)如图所示,已知SiO2的密度为![]() g/cm3,设阿伏加德罗常数的值为NA,则SiO2晶胞的边长为___pm。
g/cm3,设阿伏加德罗常数的值为NA,则SiO2晶胞的边长为___pm。
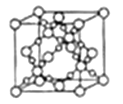
查看答案和解析>>
科目: 来源: 题型:
【题目】下表中阿拉伯数字(1、2…)是元素周期表中行或列的序号。请参照元素A~I在周期表中的位置,回答下列问题。
1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 | |
1 | A | |||||||
2 | B | C | D | E | ||||
3 | F | G | H | I |
(1)B、C两元素中非金属性较强的是________(写出元素名称),I元素在周期表中的位置是__________。
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式_________。
(3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1∶1和1∶2的两种共价化合物X和Y,请写出Y的电子式_________,该元素还能与A~I中的另一种元素以原子个数之比为1∶1和1∶2形成两种离子化合物Z和M,用电子式表示M的形成过程:____。
(4)表中某两种元素的气态单质可以形成燃料电池,其产物清洁无污染,请写出碱性环境中负极反应式____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com