
科目: 来源: 题型:
【题目】如图所示分别是某课外活动小组设计的制取氨气并用氨气进行喷泉实验的三组装置,回答下列问题:
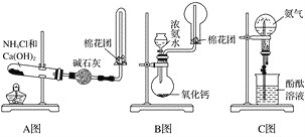
(1)用A图所示的装置可制备干燥的NH3:
①反应的化学方程式为____。装置中收集NH3的试管口放置棉花团的作用是____。
②干燥管中干燥剂能否改用无水CaCl2?____(填“能”或“不能”),理由是___(用化学方程式表示)。
(2)用B图所示的装置可快速制取较大量NH3:
①用化学方程式表示浓氨水滴入CaO中有大量NH3逸出的过程:_____。
②检验NH3是否收集满的实验方法是_____。
(3)用C图所示的装置进行喷泉实验,上部烧瓶已充满干燥氨气,引发水上喷的操作是____,该实验的原理是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
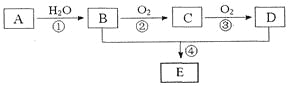
请回答下列问题:
(1)B、D分子中的官能团名称分别是__________、__________。
(2)写出下列反应的化学方程式,并注明反应类型:
②____________________,___________;④____________________,___________。
(3)在实验室利用B和D制备E的实验中,若用1mol B和1 mol D充分反应,能否生成1mol E_________,原因是__________。
(4)若184g B和120g D反应能生成106g E,则该反应的产率______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据信息回答下列问题:
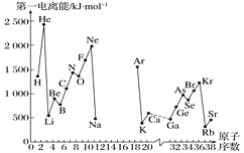
A.第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的最低能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
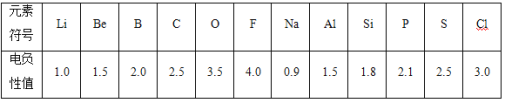
B.不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性。一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7,通常形成共价键。下表是某些元素的电负性值:
(1)认真分析信息A图中同周期元素第一电离能的变化规律,推断第三周期Na~Ar这几种元素中,Al的第一电离能的大小范围为______<Al<________(填元素符号)。
(2)从信息A图中分析可知,同一主族元素原子的第一电离能I1的变化规律是______________:
(3)信息A图中第一电离能最小的元素在周期表中的位置是_______周期__________族。
(4)根据对角线规则,Be、Al元素最高价氧化物对应水化物的性质相似,它们都具有_______性,其中Be(OH)2显示这种性质的离子方程式是____________。
(5)通过分析电负性值的变化规律,确定Mg元素的电负性值的最小范围_________。
(6)请归纳元素的电负性和金属性、非金属性的关系是__________。
(7)从电负性角度,判断AlCl3是离子化合物还是共价化合物___________,说出理由并写出判断的方法_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】两种气态烃以任意比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是 ( )
A.CH4 C2H4B.CH4 C3H4C.C2H4 C3H4D.C2H2 C3H6
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
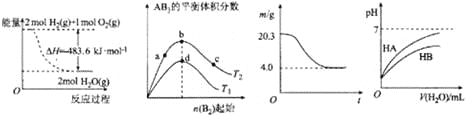
图Ⅰ 图Ⅱ 图Ⅲ 图Ⅳ
A. 图Ⅰ表示H2与O2发生反应过程中的能量变化,则H2的燃烧热△H=-241.8 kJ·mol-1
B. 图Ⅱ表示反应A2 (g)+ 3B2 (g)![]() 2AB3(g),达到平衡时A2的转化率大小为:b>a>c
2AB3(g),达到平衡时A2的转化率大小为:b>a>c
C. 图Ⅲ表示0.1mol MgCl2·6H2O在空气中充分加热时固体质量随时间的变化
D. 图Ⅳ表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于同浓度NaB溶液的pH
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关化学反应速率和限度的说法中,正确的是( )
A.铁与硝酸反应时,其他条件一定时,硝酸越浓,反应速率越快
B.在金属钠与足量水反应中,增加水的量能加快反应速率
C.在2SO2+O2![]() 2SO3反应中加入18O2,达到平衡后SO2中不可能含有18O2
2SO3反应中加入18O2,达到平衡后SO2中不可能含有18O2
D.无论是吸热还是放热反应,加热都能加快化学反应速率
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 对于A(s)+B(g) ![]() C(g)+D(g)的反应,加入A,反应速率加快
C(g)+D(g)的反应,加入A,反应速率加快
B. 2NO2![]() N2O4(正反应放热),升高温度,v(正)增大,v(逆)减小
N2O4(正反应放热),升高温度,v(正)增大,v(逆)减小
C. 一定温度下,反应 N2(g)+3H2(g) ![]() 2NH3(g)在密闭容器中进行,恒压,充入He不改变化学反应速率
2NH3(g)在密闭容器中进行,恒压,充入He不改变化学反应速率
D. 100 mL2 mol·L—1稀盐酸与锌反应时,加入少量硫酸铜固体,生成氢气的速率加快
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为K=[(CO2)·(H2)]/[(CO)·(H2O)]在不同的温度下该反应的平衡常数如下表所示:

下列有关叙述不正确的是( )
A. 该反应的化学方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO2为0.4 mol时,该反应达到平衡状态
C. 某温度下,如果平衡浓度符合下列关系式:(CO2)/3(CO)=(H2O)/5(H2),判断此时的温度是1 000 ℃
D. 该反应为吸热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】硝酸是一种重要的化工原料,氨氧化法是工业生产中制取硝酸的主要途径,某兴趣小组在实验室模拟氨氧化法制硝酸,实验装置如图所示,回答下列问题:

(注:氯化钙可以与NH3反应生成八氨合氯化钙。)
(1)仪器a的名称为________,其中加的试剂为______________。
(2)实验时先点燃C中的酒精灯,当催化剂Cr2O3由暗绿色变为微红时通入空气,3 min后Cr2O3出现暗红色,移去酒精灯,Cr2O3能保持红热状态的原因是________,装置C中发生反应的总反应化学方程式为______________________。
(3)装置D的作用是__________________________;
装置G的作用是______________________。
(4)反应开始后,在装置E中看到的现象是______________________。
(5)实验结束后,证明有HNO3生成的操作是______________________。
(6)为测定所制硝酸的浓度,反应结束后取20 mL装置F中的液体,加水稀释至1000 mL后,取出20 mL加入锥形瓶中,滴加指示剂,然后用0.100 mol/L的NaOH溶液滴定,用去25 mL NaOH溶液,则反应制得的硝酸的浓度为________mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)![]() CO2(g)+H2(g),CO2的平衡浓度c(CO2)与温度T的关系如图所示。
CO2(g)+H2(g),CO2的平衡浓度c(CO2)与温度T的关系如图所示。
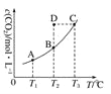
下列说法错误的是
A. 反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的 ΔH﹥0
CO2(g)+H2(g)的 ΔH﹥0
B. 在T2时,若反应处于状态D,则一定有ν(正)﹥ν(逆)
C. 平衡状态A与C相比,平衡状态A的c(CO)大
D. 若T1、T2时的平衡常数分别为K1、K2,则K1﹤K2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com