
科目: 来源: 题型:
【题目】丙烯酸甲酯(CH2=CHCOOCH3)是一种重要的有机化工原料。实验室制备少量丙烯酸甲酯的反应为:CH2=CHCOOH+CH3OH![]() CH2=CHCOOCH3+H2O,步骤如下:
CH2=CHCOOCH3+H2O,步骤如下:
步骤1:在100mL圆底烧瓶中依次加入10.0g丙烯酸、少许碎瓷片、10mL甲醇和2mL浓硫酸,搅拌。
步骤2:如图,连接装置,加热烧瓶中的混合液,用锥形瓶盛接通过分水器分离出的水。当不再有水生成,停止加热。
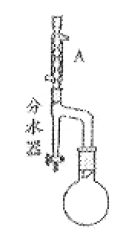
步骤3:反应液冷却后,依次用5%Na2CO3溶液、饱和食盐水、水洗涤。
分离出有机相。
步骤4;向有机相中加无水Na2SO4固体,过滤后蒸馏,收集70~90℃馏分。测得丙烯酸甲酯的质量为6.45g。
可能用到的信息:
密度 | 沸点 | 溶解性 | ||
丙烯酸 | 1.05 g·cm-3 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
甲醇 | 0.79 g·cm-3 | 65℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
丙烯酸甲酯 | 0.95 g·cm-3 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
请回答下列问题:
(1)步骤1中,加入碎瓷片的目的是___。
(2)步骤2中,图中所示装置中仪器A的名称是___,其作用为___。
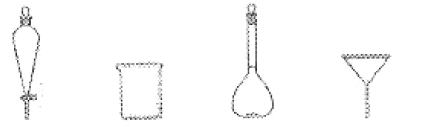
(3)步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是___;分离有机相的操作名称为__,分离有机相时不需要用到下列玻璃仪器中的__ (填名称)。
(4)实验中可能生成的有机副产物结构简式为____ (填一种即可)。
(5)本实验中丙烯酸甲酯的产率为___%。实际产率低于理论值的原因有多种,下列所述原因中不可能的是___ (填字母)。
a.分水器收集的水里含丙烯酸甲酯 b.本实验条件下发生了副反应
c.产品在洗涤、蒸发过程中有损失 d.产品精制时收集部分低沸点物质
(6)本实验中需要采取的安全防护措施有____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定溶液中一定能大量共存的离子组是
A. 含有大量AlO![]() 的溶液中:Na+、K+、HCO3-、NO3-
的溶液中:Na+、K+、HCO3-、NO3-
B. pH=1的溶液中:NH4+、Na+、Fe3+、SO42-
C. 水电离产生c(H+)=1×10-13 mol/L溶液中:K+、Al3+、Cl-、SO42-
D. Na2S溶液中:SO42-、K+、Cu2+、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】关于化学反应速率和限度,下列说法正确的是:
A. 密闭容器中进行的如下反应:2X(g)+Y(g)![]() Z(g)+W(s) ΔH>0,升高温度,正反应速率增大,逆反应速率减小
Z(g)+W(s) ΔH>0,升高温度,正反应速率增大,逆反应速率减小
B. 对于反应:H2S(g) ![]() H2(g)+S(s) ΔH>0 ,加压或降温都能使化学平衡向逆反应方向移动
H2(g)+S(s) ΔH>0 ,加压或降温都能使化学平衡向逆反应方向移动
C. 一定条件下,2L 密闭容器中存在反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0。达平衡后再充入一定量的CO(g),平衡正向移动,平衡常数K变大
CO2(g)+H2(g) △H<0。达平衡后再充入一定量的CO(g),平衡正向移动,平衡常数K变大
D. 增大反应物的浓度,平衡向右移动,生成物的百分含量不一定增大
查看答案和解析>>
科目: 来源: 题型:
【题目】Pb为第ⅣA元素。常见的化合价为+2和+4,其单质和化合物都有着广泛的用途。
己知Pb2+可以和EDTA|乙二胺四乙酸(HOOCCH2)2NCH2-CH2N(CH2COOH)2|形成无色的1:1的稳定络合物。
请回答下列问题:
(1)基态Pb原子价电子排布式为___
(2)碳、硅与铅同主族。碳纳米管可以制成透明导电的薄膜,其结构类似于石墨晶体,则多层碳纳米管的层与层之间靠___结合在一起。四卤化硅(SiX4)均是无机化工品,其沸点按F、Cl、Br、I依次升高的原因是____
(3)在EDTA中,碳原子的杂化方式有____、___。组成EDTA的四种元素中第一电离能最大的是____
(4)Pb(NO3)2中阴离子的立体构型是____,写出一个与该阴离子立体构型相同的分子的化学式___
(5)Sn与Pb同为第ⅣA元素。请用价层电子对互斥理论推断SnBr2分子中Sn-Br的键角___120°(填“>” “<即或“=”)。
(6)Pb与Ti、O构成的晶体可用于制造复合电子陶瓷,该晶体的晶胞如图所示,其中Pb、Ti、O分别位于顶点、体心和面心,该晶体的化学式为___,若晶胞参数为a nm,则Pb与O间的最短距离为___nm,与Pb紧邻的O个数为___

查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组为探究铁和浓硫酸反应的产物及性质,用如图所示装置进行实验![]() 夹持装置和A中加热装置已略,气密性已检验
夹持装置和A中加热装置已略,气密性已检验![]()
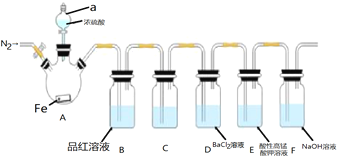
实验开始前,先打开弹簧夹通一段时间N2,关闭弹簧夹后,在A中滴加一定量的浓硫酸,观察实验现象,然后加热,观察到A中有白雾生成,铁片上有气泡产生。已知A中白雾是硫酸与水形成的酸雾。请回答下列问题:
(1)仪器a的名称是___;
(2)加热一段时间后发现B装置中溶液褪色,取出A中的溶液少许,加入KSCN溶液未出现血红色,写出此时A中反应的化学方程式:___;
(3)C装置的作用是除去二氧化硫气体中硫酸蒸汽,则盛放的溶液是___;
A.水 B.NaOH溶液 C.饱和Na2SO3溶液 D.饱和NaHSO3溶液
(4)实验开始前,先通一段时间N2的目的是___;
(5)可以证明H2SO3是弱酸的实验装置是___;
(6)E中的现象是___,该现象表明SO2具有___性;
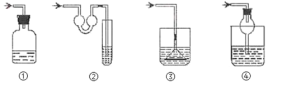
(7)装置F的作用是吸收尾气,写出该装置中反应的化学方程式___,以下各种尾气吸收装置中,适合于吸收该尾气,而且能防止倒吸的是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸溶液中存在电离平衡:CH3COOH![]() H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
A. 0.1 mol/L 的CH3COOH 溶液加水稀释或加热均可使CH3COO-的物质的量增多
B. 0.1 mol/L 的CH3COOH 溶液加水稀释,c(CH3COO-)/[c(CH3COOH) ·c(OH-)]不变
C. 向0.1 mol/L CH3COOH溶液中加入少量纯醋酸,平衡向右移动,电离程度增大
D. 0.1 mol/L CH3COOH溶液加水稀释后,溶液中c(CH3COOH)/c(CH3COO-)的值减小
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质
①O2和O3 ②H2、D2、T2 ③12C和14C ④CH3CH2CH2CH3和(CH3)2CHCH3 ⑤乙烷和丁烷 ⑥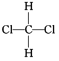 和
和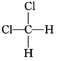 ⑦
⑦![]() 和
和![]() ⑧氯气和氯水 ⑨红磷和白磷
⑧氯气和氯水 ⑨红磷和白磷
互为同位素的是___(填序号,下同),互为同素异形体的是___,互为同系物的是__,互为同分异构体的是__,属于同一物质的是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】1.28g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到VmL气体(标准状况),将盛有此气体的容器倒扣在水中,通入氧气恰好使气体完全溶解在水中,则需要标准状况下的氧气体积为( )
A. 504mLB. 336mLC. 224mLD. 168mL
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室为准确测定FeSO4的浓度,可用重铬酸钾标准溶液进行滴定。(已知重铬酸钾被还原为Cr3+)
步骤1.用分析天平准确称取2.9400g重铬酸钾,配制500mL重铬酸钾标准溶液;
步骤2.移取25.00mL所配制的重铬酸钾标准溶液于500mL锥形瓶中,用蒸馏水稀释至250mL,再加20mL浓硫酸,冷却后,加2~3滴试亚铁灵指示剂;
步骤3.用待测硫酸亚铁溶液滴定至溶液由橙黄到绿,由绿色刚变为红紫色为终点;
步骤4.记录消耗硫酸亚铁溶液的体积为18.70 mL。
(1)配制500mL重铬酸钾标准溶液需要的玻璃仪器有量筒、烧杯、 ____________________
(2)移取K2Cr2O7溶液选用的仪器是___________,盛装待测硫酸亚铁溶液选用的仪器是___________
A.50mL酸式滴定管 B.25mL碱式滴定管 C.25mL量筒
(3)氧元素位于周期表的______分区,铁元素在周期表中的位置是___________________,Fe2+的简化电子排布式为_________________,基态铬原子的价电子电子排布图为 __________________。
(4)测得FeSO4的浓度为 ______________ 。(小数点后保留两位数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于四个“封管实验”![]() 夹持装置未画出、
夹持装置未画出、![]() 固体易升华
固体易升华![]() 的说法正确的是
的说法正确的是
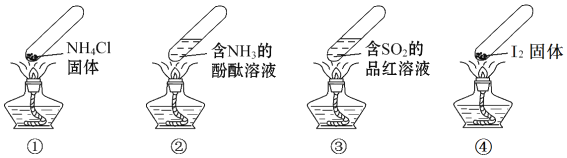
A. 加热时,![]() 中封管内固体消失
中封管内固体消失
B. 加热时,![]() 中溶液变红,冷却后又变为无色
中溶液变红,冷却后又变为无色
C. 加热时,![]() 中溶液变红,冷却后红色褪去,体现
中溶液变红,冷却后红色褪去,体现![]() 的漂白性
的漂白性
D. 加热又冷却的过程中,![]() 属于物理变化,
属于物理变化,![]() 属于化学变化
属于化学变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com