
科目: 来源: 题型:
【题目】下列各性质中符合图示关系的是
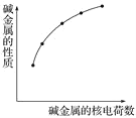
①化合价 ②ROH的碱性 ③密度 ④最外层电子数 ⑤核外电子层数 ⑥单质失e-能力
A.②④⑤⑥B.②⑤⑥C.②③⑤⑥D.①②③⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A. 石油分馏可获得汽油、煤油、石蜡等矿物油,煤焦油干馏可获得苯、甲苯等有机物
B. 生活中常见的聚乙烯、聚氯乙烯、纶、有机玻璃、合成橡胶都是通过加聚反应得到的
C. 按系统命名法,有机物 可命名为2,2,4,4,5—五甲基—3,3—二乙基己烷
可命名为2,2,4,4,5—五甲基—3,3—二乙基己烷
D. 碳原子数≤6的链状单烯烃,与HBr反应的产物只有一种结构,符合条件的单烯烃有4种(不考虑顺反异构)
查看答案和解析>>
科目: 来源: 题型:
【题目】2014年5月7日,天津某工程检测公司在进行探伤作业期间,一枚黄豆粒大小的放射源铱-192丢失,造成了严重的安全事故,图示是铱在元素周期表中的信息,下列说法正确的是( )
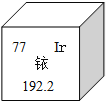
A. 铱的相对原子质量为192.2克
B. 铱原子核内的中子数为77
C. K2IrO3中Ir的化合价为+4
D. 生活中常用的铱金笔为纯净的铱单质
查看答案和解析>>
科目: 来源: 题型:
【题目】四溴化碳是一种灰白色粉末,熔点为94~95℃,广泛用于有机化合物的溴代、农药的制备等。某合作学习小组的同学拟用丙酮和液溴制备四溴化碳,其原理为CH3COCH3+4Br2+5NaOH→CBr4+CH3COONa+4NaBr+4H2O。回答下列问题:
Ⅰ.制取Br2
(1)甲组同学拟用溴化钠、二氧化锰及浓硫酸制备液溴,其实验装置如图1所示:
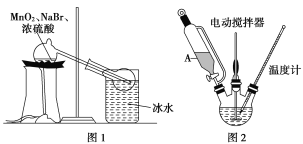
①该装置不用橡皮塞及橡皮管,其原因是___________________;
②冰水的作用是__________________________。
Ⅱ.制取CBr4
(2)乙组同学拟利用甲组同学制得的液溴与CH3COCH3(沸点56.5℃)等试剂制取四溴化碳。实验步骤如下:
步骤1:向图2中三颈烧瓶中加入11.4 g NaOH和46 mL水,搅拌。
步骤2:冰水浴冷却至2℃时,开始不断滴加液溴20 g,滴加完毕后在5℃下保持20 min。
步骤3:加入少量相转移试剂,在不断搅拌下滴入1.6 g丙酮,维持温度在5~10℃,连续搅拌4 h。
步骤4:过滤、冷水洗涤、减压烘干,得产品8.3 g。
①步骤2滴入Br2之前,冷却至2℃的目的是__________________________
②步骤4洗涤时,如何证明已洗涤干净: ___________________________。
③本次实验中产品的产率为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有A、B、C、D、E五种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥E、C同主族,且E比C多两个电子层,E单质可与冷水反应生成氢气.
试回答:
(1)A在元素周期表中的位置___,B的离子结构示意图___,化合物NH4D(含D-的铵盐)的电子式___。
(2)C的某种简单阳离子,其原子核中含22个中子,其化学符号为___;元素D最高价氧化物的水化物化学式为___。
(3)B、C、E三种元素的金属性按照由强到弱的顺序排列应为:___(用元素符号表示)。
(4)写出单质B和氢氧化钠溶液反应的离子方程式:___。
(5)写出E与冷水反应的离子方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】燃煤会产生CO2、CO、SO2等大气污染物。燃煤脱硫的相关反应的热化学方程式如下:
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) ΔH1 =+281.4kJ/mol (反应Ⅰ)
CaO(s)+SO2(g)+CO2(g) ΔH1 =+281.4kJ/mol (反应Ⅰ)
![]() CaSO4(s)+CO(g)
CaSO4(s)+CO(g)![]()
![]() CaS(s)+CO2(g) ΔH2 = -43.6kJ/mol (反应Ⅱ)
CaS(s)+CO2(g) ΔH2 = -43.6kJ/mol (反应Ⅱ)
(1)计算反应CaO(s)+3CO(g )+SO2(g) ![]() CaS(s)+3CO2(g) ΔH=____________。
CaS(s)+3CO2(g) ΔH=____________。
(2)一定温度下,向某恒容密闭容器中加入CaSO4(s)和1molCO,若只发生反应I,下列能说明该反应已达到平衡状态的是_____________(填序号)
a.容器内的压强不发生变化 b.υ正(CO)=υ正(CO2)
c.容器内气体的密度不发生变化 d.n(CO)+n(CO2)=1mol
(3)一定温度下,体积为1L容器中加入CaSO4(s)和1molCO,若只发生反应II,测得CO2的物质的量随时间变化如下图中曲线A所示。
①在0~2min内的平均反应速率v(CO)=____________。
②曲线B表示过程与曲线A相比改变的反应条件可能为____________(答出一条即可)。

(4)烟道气中的SO2和CO2均是酸性氧化物,也可用氢氧化钠溶液吸收。
已知:25℃时,碳酸和亚硫酸的电离平衡常数分别为:
碳酸 K1=4.3×10-7 K2=5.6×10-11
亚硫酸K1=1.5×10-2 K2=1.0×10-7
①下列事实中,不能比较碳酸与亚硫酸的酸性强弱的是________(填标号)。
a.25℃下,饱和碳酸溶液pH大于饱和亚硫酸溶液pH
b.25℃下,等浓度的NaHCO3溶液pH大于NaHSO3溶液
c.将SO2气体通入NaHCO3溶液,逸出气体通入澄清石灰水,澄清石灰水变浑浊
d.将CO2气体通入NaHSO3溶液,逸出气体通入品红溶液,品红溶液不褪色
②25℃时,氢氧化钠溶液吸收烟道气,得到pH=6的吸收液,该溶液中c(SO32-):c(HSO3-)=___________。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验的说法不正确的是
A. 用如图电子天平称量固体,读数时侧门应关闭

B. 用托盘天平称取10.2 g NaOH固体时,将10g的砝码放在右盘,将游码移到0.2g的位置
C. 分光光度计可用于分析溶液颜色与反应物(生成物)浓度的关系,从而确定化学反应速率
D. 吸入氯气、氯化氢气体时,可吸入少量酒精或乙醚的混合蒸气解毒
查看答案和解析>>
科目: 来源: 题型:
【题目】铝土矿的主要成分为Al2O3和SiO2(含有少量不溶性杂质),利用铝土矿制备Al(OH)3流程如下(所用化学试剂均过量)。
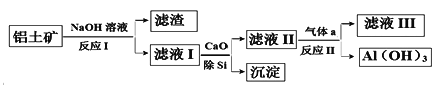
下列说法不正确的是
A. Al(OH)3可用作治疗胃酸过多
B. 加CaO除Si得到的沉淀主要成分为H2SiO3
C. 气体a成分为CO2
D. 滤液III中溶质为Ca(HCO3)2和NaHCO3
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)图为氢氧燃料电池原理示意图,按照此图的提示,回答以下问题:
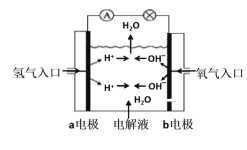
①下列叙述不正确的是___。
A.a电极是负极
B.b电极的电极反应为:4OH--4e-=2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
②若电解质溶液为KOH溶液,则电极反应式为:a极__,b极___。
(2)以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。回答下列问题:
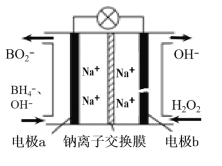
①电池放电时Na+移动方向是:__(填“从左向右”或“从右向左”)。
②电极b采用MnO2,MnO2的作用是__。
③该电池的负极反应为:__。
④每消耗3molH2O2,转移的电子数为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com