
����Ŀ��ȼú�����CO2��CO��SO2�ȴ�����Ⱦ�ȼú�������ط�Ӧ���Ȼ�ѧ����ʽ���£�
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) ��H1 =+281.4kJ/mol (��Ӧ��)
CaO(s)+SO2(g)+CO2(g) ��H1 =+281.4kJ/mol (��Ӧ��)
![]() CaSO4(s)+CO(g)
CaSO4(s)+CO(g)![]()
![]() CaS(s)+CO2(g) ��H2 = -43.6kJ/mol (��Ӧ��)
CaS(s)+CO2(g) ��H2 = -43.6kJ/mol (��Ӧ��)
(1)���㷴ӦCaO(s)+3CO(g )+SO2(g) ![]() CaS(s)+3CO2(g) ��H=____________��
CaS(s)+3CO2(g) ��H=____________��
(2)һ���¶��£���ij�����ܱ������м���CaSO4(s)��1molCO����ֻ������ӦI��������˵���÷�Ӧ�Ѵﵽƽ��״̬����_____________������ţ�
a�������ڵ�ѹǿ�������仯 b������(CO)=����(CO2)
c��������������ܶȲ������仯 d��n(CO)+n(CO2)=1mol
(3)һ���¶��£����Ϊ1L�����м���CaSO4(s)��1molCO����ֻ������ӦII�����CO2�����ʵ�����ʱ��仯����ͼ������A��ʾ��
����0~2min�ڵ�ƽ����Ӧ����v(CO)=____________��
������B��ʾ����������A��ȸı�ķ�Ӧ��������Ϊ____________(���һ������)��

(4)�̵����е�SO2��CO2�������������Ҳ��������������Һ���ա�
��֪��25��ʱ��̼���������ĵ���ƽ�ⳣ���ֱ�Ϊ��
̼�� K1=4.3��10-7 K2=5.6��10-11
������K1=1.5��10��2 K2=1.0��10-7
��������ʵ�У����ܱȽ�̼���������������ǿ������________�����ţ���
a.25���£�����̼����ҺpH���ڱ�����������ҺpH
b.25���£���Ũ�ȵ�NaHCO3��ҺpH����NaHSO3��Һ
c.��SO2����ͨ��NaHCO3��Һ���ݳ�����ͨ�����ʯ��ˮ������ʯ��ˮ�����
d.��CO2����ͨ��NaHSO3��Һ���ݳ�����ͨ��Ʒ����Һ��Ʒ����Һ����ɫ
��25��ʱ������������Һ�����̵������õ�pH=6������Һ������Һ��c(SO32-)��c(HSO3-)=___________��
��H2SO3��Һ��NaHCO3��Һ��Ӧ����Ҫ���ӷ���ʽΪ___________________��
���𰸡�-455.8kJ/mol ac 0.45mol/(Lmin) �������(������ѹǿ) ac 1��10 H 2SO3+HCO3-=H SO3-+CO2��+H2O
��������
(1)��ӦII��4����ӦI�������ɵø÷�Ӧ���Ȼ�ѧ����ʽ��
(2)���ڷ�Ӧ�й���μӵķ�Ӧ���ҷ�Ӧǰ������������ȵĿ��淴Ӧ���������ѹǿ���䡢���ʵĺ������䡢���ʵ�ת���ʲ��䡢���ʵ�Ũ�Ȳ�����Ӧ����ƽ��״̬��
(3)���ȸ���2min��CO2�����ʵ����仯����v(CO2)��Ȼ����ݷ���ʽ��CO��CO2�Ĺ�ϵ�����v(CO)��
�ڸ�������B������A�Ƚ����ʿ죬ƽ��ʱn(CO2)���������
(4)�����������ǿ����ͨ���Ƚϵ���ƽ�ⳣ����С��ǿ����������η�Ӧ������ȡ���ᡢ��Խ��������Ӧ��ǿ�����ˮ��̶�Խ����Һ�ļ��Ծ�Խǿ�����жϣ�
�ڸ���H2SO3�ĵ���ƽ�ⳣ��Ka2����c(SO32-)��c(HSO3-)��
�����õ���ƽ�ⳣ���ж���Һ�����ԣ�Ȼ�����ǿ����������η�Ӧ��ȡ������д��Ӧ����ʽ��
(1) ��ӦII��4����ӦI�������ɵø÷�Ӧ���Ȼ�ѧ����ʽCaO(s)+3CO(g )+SO2(g) ![]() CaS(s)+3CO2(g) ��H=��455.8kJ/mol��
CaS(s)+3CO2(g) ��H=��455.8kJ/mol��
(2)���ڿ��淴Ӧ��CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)���й���μӣ���ǰ������������ȡ�
CaO(s)+SO2(g)+CO2(g)���й���μӣ���ǰ������������ȡ�
a.����Ӧδ�ﵽƽ�⣬�������ѹǿ�仯���������ڵ�ѹǿ�������仯����Ӧ����ƽ��״̬��a��ȷ��
b.���ڷ���ʽ��CO��CO2�ļ�������ȣ��������κ�ʱ������(CO)=����(CO2)����ʾ��Ӧ������У�����ȷ����Ӧ����ƽ��״̬��b����
c.����Ӧδ�ﵽƽ��״̬������������ͻᷢ���仯�������������ݻ����䣬��������������ܶȾͻᷢ���仯��������������ܶȲ��䣬��Ӧ����ƽ��״̬��c��ȷ��
d.����CԪ���غ㣬���۷�Ӧ�Ƿ���ƽ��״̬��n(CO)+n(CO2)���ǵ���1mol�����Բ��ܾݴ��жϷ�Ӧ�Ƿ���ƽ��״̬��d����
�ʺ���ѡ����ac��
(3)�ٸ���ͼ���֪��2min��CO2�����ʵ����仯��0.9mol����v(CO2)=![]() =0.45mol/(Lmin)�����ݷ���ʽCaSO4(s)+CO(g)
=0.45mol/(Lmin)�����ݷ���ʽCaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)��֪��v(CO)= v(CO2)= 0.45mol/(Lmin)��
CaO(s)+SO2(g)+CO2(g)��֪��v(CO)= v(CO2)= 0.45mol/(Lmin)��
�ڸ������߱仯��֪������B������A�Ƚϣ���Ӧ���ʿ죬���ﵽƽ��ʱn(CO2)���䣬��֪ƽ��δ�����ƶ������ڷ�Ӧ![]() CaSO4(s)+CO(g)
CaSO4(s)+CO(g)![]()
![]() CaS(s)+CO2(g)�Ƿ�Ӧǰ�����������ȵķ�Ӧ�����Ըı������ֻ������ʹ�ô���������ѹǿ��
CaS(s)+CO2(g)�Ƿ�Ӧǰ�����������ȵķ�Ӧ�����Ըı������ֻ������ʹ�ô���������ѹǿ��
(4)��a.����SO2��CO2��ˮ���ܽ�Ȳ�ͬ������25���£�������Һ��Ũ�Ȳ�ͬ����˾Ͳ���ͨ���Ƚϱ���̼����ҺpH�뱥����������Һ��pH�ж��������ǿ����a�������⣻
b.H2CO3��H2SO3�������ᣬ����NaHCO3��NaHSO3����ǿ�������Σ������ε�ˮ����ɣ�˭��˭ˮ�⣬˭ǿ��˭�ԣ�Խ��Խˮ�⣬��25���£���Ũ�ȵ�NaHCO3��ҺpH����NaHSO3��Һ��˵������H2CO3<H2SO3��b���������⣻
c.SO2����ˮ����Ӧ����H2SO3����SO2����ͨ��NaHCO3��Һ���ݳ�����ͨ�����ʯ��ˮ������ʯ��ˮ����ǣ�CO2��SO2������ʹ����ʯ��ˮ����ǣ����۶����Ƿ�Ӧ���õ������嶼����ʹ����ʯ��ˮ����ǣ���˲���˵����Ӧ������CO2���壬�ʲ���֤�����ԣ�H2CO3<H2SO3��c�������⣻
d.SO2����Ư���ԣ��ܹ�ʹƷ����Һ��ɫ������CO2����ͨ��NaHSO3��Һ���ݳ�����ͨ��Ʒ����Һ��Ʒ����Һ����ɫ��˵���ݳ���������CO2����֤�����ԣ�H2CO3<H2SO3��d���������⣻
�ʺ���ѡ����ac��
��������ڶ�������ƽ�ⳣ��K2=1.0��10-7����Ka2=![]() =1.0��10-7����Һ��pH=6��c(H+)=1��10-6������c(SO32-)��c(HSO3-)=
=1.0��10-7����Һ��pH=6��c(H+)=1��10-6������c(SO32-)��c(HSO3-)=![]() =1��10��
=1��10��
�۸��ݵ���ƽ�ⳣ����֪���ԣ�H2SO3>H2CO3������H2SO3��Һ��NaHCO3��Һ��Ӧ����Ҫ���ӷ���ʽΪH 2SO3+HCO3-=H SO3-+CO2��+H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaNO2��һ��ʳƷ���Ӽ��������°������� KMnO4��Һ�� NaNO2���ķ�Ӧ����ʽ��MnO4-+NO2-+����Mn2++NO3-+H2O��������������ȷ����( )
A. �÷�Ӧ�� NO2-����ԭ B. ��Ӧ��������Һ��pH ��С
C. ����1 mol NaNO3������ 0.4mol KMnO4 D. ��������� OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���X�Ľṹ��ʽ��ͼ��ʾ���������й�˵������ȷ����
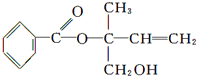
A. X�ķ���ʽΪC12H16O3
B. �������Ը��������Һ���ֱ���X
C. X��һ���������ܷ����ӳɡ��Ӿۡ�ȡ������ȥ�ȷ�Ӧ
D. ��Ni�������������£�1 mol X���ֻ����1 mol H2�ӳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܷ������з������淴Ӧ��X2+Y2![]() 2Z����֪��ʼʱX2��Y2��Z�����ʵ���Ũ�ȷֱ�Ϊ0.1mol/L��0.3mol/L��0.2mol/L����Ӧ��һ�������½��е�ijһʱ��ʱ�������ʵ����ʵ���Ũ�ȿ����ǣ� ��
2Z����֪��ʼʱX2��Y2��Z�����ʵ���Ũ�ȷֱ�Ϊ0.1mol/L��0.3mol/L��0.2mol/L����Ӧ��һ�������½��е�ijһʱ��ʱ�������ʵ����ʵ���Ũ�ȿ����ǣ� ��
A.c(X2)=0.2mol/LB.c(Y2)=0.35mol/LC.c(Y2)=0.2mol/LD.c(Z)=0.4mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪��1molH-H����1molN��N��1molN-H���ֱ���Ҫ���յ�����Ϊ436kJ��946kJ��391kJ������N2��H2��Ӧ����1molNH3��Ҫ�ų�___kJ��������
��2����0.2molX�����0.4molY��������2L�ܱ������У�ʹ���Ƿ������·�Ӧ��4X(g)+5Y(g)=nZ(g)+6W(g)��2minĩ����0.3molW������֪Z��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.05mol/(Lmin)�����㣺
��ǰ2min����Y��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ___��
�ڻ�ѧ����ʽ��n��ֵ��___��
��3��ij�¶�ʱ��2L������A��B��C������̬���ʵ����ʵ���(n)��ʱ��(t)�仯��������ͼ��ʾ����ͼ������
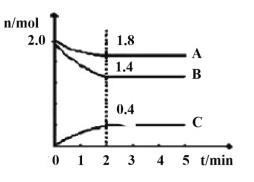
�÷�Ӧ�Ļ�ѧ����ʽΪ____��
����������˵��������Ӧ�ﵽƽ��״̬����___��
A.��������ƽ��Ħ����������ʱ��ı仯���仯
B.��ͬʱ��������2nmol��A��ͬʱ����4nmol��C
C.���������ܶȲ���ʱ��ı仯���仯
D.������ѹǿ���ٷ����仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������з���ͼʾ��ϵ����
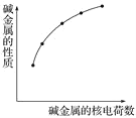
�ٻ��ϼۡ���ROH�ļ��ԡ����ܶȡ����������������ݺ�����Ӳ���������ʧe������
A.�ڢܢݢ�B.�ڢݢ�C.�ڢۢݢ�D.�٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ��ԭ��(����ĸ��ʾ)������������ԭ�������Ĺ�ϵͼ������˵������ȷ���ǣ� ��
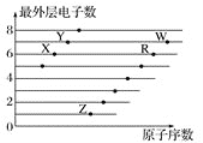
A.�⻯��е㣺H2X��H2R
B.���������ԣ�HWO��H2RO4
C.��̬�⻯����ȶ��ԣ�HY��HW��H2R
D.���Ӱ뾶��R2-��X2-��Y-��Z+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС����ʵ�����н��л�ѧʵ�飬����ͼ�����Ӻ���·���ֵ��ݲ�������ͼ�����Ӻ���·���ֵ��������ɴ˵ó��Ľ�����ȷ����(����)

A.NaCl��Һ�ǵ����
B.��ͨ��������£�NaCl��ˮ�е�������������Ӷ�����
C.NaCl���������������ӣ���˲��ܵ���
D.ͬһ�¶��£�������NaCl��Һ���ɵ�Ũ�ȵ�MgCl2��Һ����Һ��������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҵ�����ȡ���ϡ��㾫��Ⱦ�ϡ�Ϳ�ϡ�ϴ�Ӽ��Ȳ�Ʒ��ԭ�ϣ�
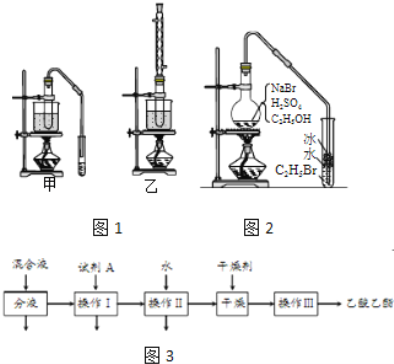
���������գ�
��1��ʵ�������Ҵ���ȡ��ϩʱ��Ũ���������ԶԶ������Ϊ����������������ԭ����______��
��2����֤��ϩ�ӳɷ�Ӧ����ʱ�������ϩ�����еĸ������ʽ��д�������ѡ�õ��Լ���______����д��ѧʽ������ȷ����ϩͨ����ˮ�з����˼ӳɷ�Ӧ����ʵ��______����ѡ���ţ�
a����ˮ��ɫ b������״��������
c����Ӧ��ˮ��Һ������ǿ d����Ӧ��ˮ��Һ�ӽ�����
��3��ʵ�������Ҵ��������Ʊ���������ʱ����������װ����ͼ1������ѡ�ã�����������װ�õ�˵����ȷ����______����ѡ���ţ�
���� | �е㣨�棩 |
�Ҵ� | 78.5 |
���� | 117.9 |
�������� | 77 |
a����װ������ת���ʸ� b����װ������ת���ʸ�
c����װ��������������ʩ d����װ��������������ʩ
��4������װ��ʵ��ʱ���ᴿ��������������������ͼ3�������������Լ�A�Ļ�ѧʽ��______����������������______��������һ�������ڷ���______����
��5����ͼ2�����Ҵ��Ʊ��������װ�ã�ʵ���������ּ��Ϸ�����
���ȼ��廯�����ټ��Ҵ�������1��1Ũ���
���ȼ��廯�����ټ�1��1Ũ�����������Ҵ���
�������ٺ͢�ʵ��ʱ�����ﶼ��������ɫ�������Թ��м���______������ɱ�Ϊ��ɫ���뷽������Ƚϣ������ڵ�����ȱ����______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com