
科目: 来源: 题型:
【题目】现有下列十种物质:①液态HCl ②NaHCO3 ③NaCl溶液 ④CO2 ⑤蔗糖晶体 ⑥Ba(OH)2 ⑦红褐色的氢氧化铁胶体 ⑧NH3H2O ⑨空气 ⑩Al2(SO4)3
(1)上述十种物质中有两种物质在水溶液中可发生反应,离子方程式为:H++OH-=H2O,该反应的化学方程式为______________________________________。
(2)②在水中的电离方程式为______________________________。
(3)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能治疗胃酸过多,请写出其反应的离子方程式_________________;如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,此时最好用含Al(OH)3的胃药(如胃舒平),它与胃酸反应的离子方程式________。
(4)写出下列反应的离子方程式:
向Ba(OH)2溶液中逐滴加入硫酸溶液___________________________。
向Ba(OH)2溶液中通入过量的CO2_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学用下列装置进行有关Cl2的实验。下列说法不正确的是( )
A.  图中:实验现象证明氯气无漂白作用,氯水有漂白作用
图中:实验现象证明氯气无漂白作用,氯水有漂白作用
B.  图中:收集氯气
图中:收集氯气
C.  图中:生成棕黄色的烟,加少量水溶解得到蓝绿色溶液
图中:生成棕黄色的烟,加少量水溶解得到蓝绿色溶液
D.  图中:若气球干瘪,证明可与NaOH溶液反应
图中:若气球干瘪,证明可与NaOH溶液反应
查看答案和解析>>
科目: 来源: 题型:
【题目】研究证明,高铁酸钾不仅能在饮用水源和废水处理过程中去除污染物,而且不产生任何诱变致癌的产物,具有高度的安全性。湿法制备高铁酸钾是目前最成熟的方法,实验步骤如下:
A.直接用天平称取60.5gFe(NO3)3·9H2O、30.0gNaOH、17.1gKOH。
B.在冰冷却的环境中向NaClO溶液中加入固体NaOH并搅拌,又想其中缓慢少量分批加入Fe(NO3)3·9H2O,并不断搅拌。
C.水浴温度控制在20℃,用电磁加热搅拌器搅拌1.5h左右,溶液成紫红色时,即表明有Na2FeO4生成。
D.在继续充分搅拌的情况下,向上述的反应液中加入固体NaOH至饱和。
E.将固体KOH加入到上述溶液中至饱和。保持温度在20℃,并不停的搅拌15min,可见到烧杯壁有黑色沉淀物生成,即K2FeO4.
(1)①步骤B中不断搅拌的目的是_______。
②步骤C中发生反应的离子方程式为______。
③由以上信息可知:高铁酸钾的溶解度比高铁酸钠_______(填“大”或“小”)。
(2)高铁酸钾是一种理想的水处理剂,与水反应生成O2、Fe(OH)3(胶体)和KOH。① 该反应的离子方程式为______。②高铁酸钾作为水处理剂发挥的作用是_______。③ 在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用_______。
A.H2O B.稀KOH溶液、异丙醇 C.NH4Cl溶液、异丙醇 D.Fe(NO3)3溶液、异丙醇
(3)高铁酸钠还可以用电解法制得,其原理可表示为Fe+2NaOH+2H2O![]() 3H2↑+Na2FeO4,则阳极材料是____,电解液为______。
3H2↑+Na2FeO4,则阳极材料是____,电解液为______。
(4)25℃时,Ksp(CaFeO4)=4.536×10-9,若要使100mL1.0×10-3mol/L的K2FeO4溶液中的c(FeO42-)完全沉淀,理论上要加入Ca(OH)2的物质的量为_____mol。
(5)干法制备高铁酸钾的方法是Fe2O3、KNO3、KOH混合加热共熔生成黑色高铁酸钾和KNO2等产物。则该方法中氧化剂与还原剂的物质的量之比为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要450mL 1mol/L的硫酸,现用密度为1.84g/㎝3,溶质的质量分数98%的浓硫酸来配制,有关说法正确的是(设NA阿伏加德罗常数的值)
A. 配制溶液时需的仪器只需要500mL容量瓶、烧杯、玻璃棒、量筒
B. 配制溶液定容时,仰视读数会使溶液的实际浓度偏大
C. 65克单质锌与一定量的该浓硫酸完全反应,生成的气体质量可能为32克
D. 配制该溶液所需浓硫酸体积为24mL
查看答案和解析>>
科目: 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会生成副产物HCl,利用下列反应可实现氯的循环利用:4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是( )
2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是( )
A. 混合气体的密度不再改变
B. 氯化氢的转化率不再改变
C. 断开4 mol H—Cl键的同时生成4 mol H—O键
D. n(HCl)∶n(O2)∶n(Cl2)∶n(H2O)=4∶1∶2∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式中书写正确的是( )
A.碳酸氢钙溶液跟盐酸反应:HCO3-+H+=H2O+CO2↑
B.氯气跟水反应:Cl2+H2O=2H++Cl-+ClO-
C.碳酸氢钠溶液和氢氧化钙溶液混合HCO3-+OH-=CO32-+H2O
D.碳酸钠溶液中滴加少量盐酸CO32-+2H+=CO2↑+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下表所示实验,现象和结论均正确的是
选项 | 实验 | 现象 | 结论 |
A | 向浓度均为0.lmol/LNaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
B | 常温下,测定等物质的量浓度的 Na2CO3和Na2SO3溶液的pH值 | 前者的pH值比后者的大 | 非金属性:S>C |
C | 向某溶液中加入硝酸酸化的氯化钡溶液 | 溶液中有白色沉淀生成 | 该溶液中含有SO42- |
D | 向FeCl3和KSCN混合溶液中,加入少量KC1固体 | 溶液颜色变浅 | FeCl3+3KSCN |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】实验是化学研究的基础。下列关于各实验装置的叙述正确的是( )

A. 装置①常用于分离互不相溶的液体混合物
B. 装置②可用于吸收NH3或HCl气体,并防止倒吸
C. 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
D. 装置③可用于收集H2、CO2、Cl2、NH3等气体
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值,下列判断正确的是
A. 高温下,5.6 g Fe与足量水蒸气反应,转移的电子数为0.3NA
B. 标准状况下,22.4 L NO和11.2 L O2充分反应,产物的分子数为NA
C. 60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA
D. 向含有0.2 mol NH4Al(SO4)2的溶液中滴加NaOH 溶液至沉淀恰好完全溶解,所消耗OH-的数目为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A. 热纯碱溶液比冷的纯碱溶液洗涤油污的能力强
B. 向MgCO3沉淀中滴加NaOH溶液可以得到Mg(OH)2沉淀
C. 水的离子积随温度变化如表格所示: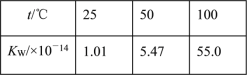
D. 对CO(g)+NO2(g) ![]() CO2(g)+NO(g)平衡体系增大压强可使颜色变深
CO2(g)+NO(g)平衡体系增大压强可使颜色变深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com