
【题目】现有下列十种物质:①液态HCl ②NaHCO3 ③NaCl溶液 ④CO2 ⑤蔗糖晶体 ⑥Ba(OH)2 ⑦红褐色的氢氧化铁胶体 ⑧NH3H2O ⑨空气 ⑩Al2(SO4)3
(1)上述十种物质中有两种物质在水溶液中可发生反应,离子方程式为:H++OH-=H2O,该反应的化学方程式为______________________________________。
(2)②在水中的电离方程式为______________________________。
(3)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能治疗胃酸过多,请写出其反应的离子方程式_________________;如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,此时最好用含Al(OH)3的胃药(如胃舒平),它与胃酸反应的离子方程式________。
(4)写出下列反应的离子方程式:
向Ba(OH)2溶液中逐滴加入硫酸溶液___________________________。
向Ba(OH)2溶液中通入过量的CO2_______________________________。
【答案】Ba(OH)2+2HCl=BaCl2+2H2O NaHCO3=Na++HCO3-(或NaHCO3=Na++HCO3- HCO3- ![]() H++CO32-,第二步写错不得分) HCO3-+H+═H2O+CO2↑ Al(OH)3+3H+═3H2O+Al3+ Ba2++SO42-+2H++2OH-═2H2O+BaSO4↓ CO2+OH-=HCO3-
H++CO32-,第二步写错不得分) HCO3-+H+═H2O+CO2↑ Al(OH)3+3H+═3H2O+Al3+ Ba2++SO42-+2H++2OH-═2H2O+BaSO4↓ CO2+OH-=HCO3-
【解析】
(1)离子方程式为:H++OH-═H2O,可表示强酸与强碱反应生成可溶性盐和水的离子反应;
(2)碳酸为弱电解质,HCO3-不拆开;
(3)NaHCO3与盐酸反应生成氯化钠、水和二氧化碳;Al(OH)3与盐酸反应生成氯化铝和水;
(4)Ba(OH)2溶液中逐滴加入稀硫酸,反应生成硫酸钡和水;向Ba(OH)2溶液中通入过量的CO2反应生成碳酸氢钡。
(1)离子方程式为:H++OH-═H2O,可表示强酸与强碱反应生成可溶性盐和水的离子反应,如Ba(OH)2+2HCl=BaCl2+2H2O;
(2)碳酸为弱电解质,HCO3-不拆开,NaHCO3=Na++HCO3-(或NaHCO3=Na++HCO3-,HCO3-![]() H++CO32-,第二步写错不得分);
H++CO32-,第二步写错不得分);
(3)NaHCO3与盐酸反应生成氯化钠、水和二氧化碳,离子反应为HCO3-+H+═H2O+CO2↑;Al(OH)3与盐酸反应生成氯化铝和水,离子反应为Al(OH)3+3H+═3H2O+Al3+;
(4)Ba(OH)2溶液中逐滴加入稀硫酸,反应生成硫酸钡和水,离子反应为Ba2++SO42-+2H++2OH-═2H2O+BaSO4↓,向Ba(OH)2溶液中通入过量的CO2反应生成碳酸氢钡,离子反应为CO2+OH-=HCO3-。


科目:高中化学 来源: 题型:
【题目】实验室有一包白色固体,可能含有NaCl、NaHCO3和NH4Cl中的一种或多种。下列根据实验事实得出的结论正确的是
A. 取一定量固体,在空气中充分加热,有白色物质残留,则原白色固体中含NaCl
B. 取一定量固体,加水溶解,向溶液中加入少量NaOH溶液,再滴加AgNO3溶液,有白色沉淀生成,则该白色沉淀是AgCl
C. 取一定量固体,加水溶解,向溶液中滴加足量NaOH溶液,加热,将得到气体直接通入足量浓硫酸,浓硫酸增重3.40 g,则原白色固体中含NH4Cl 10.7 g
D. 取一定量固体,加水溶解,向溶液中滴加足量Ba(OH)2溶液,有白色沉淀生成,将沉淀过滤、洗涤、干燥,得到沉淀质量为3.94 g,则原白色固体中含NaHCO3 1.68 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会生成副产物HCl,利用下列反应可实现氯的循环利用:4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是( )
2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是( )
A. 混合气体的密度不再改变
B. 氯化氢的转化率不再改变
C. 断开4 mol H—Cl键的同时生成4 mol H—O键
D. n(HCl)∶n(O2)∶n(Cl2)∶n(H2O)=4∶1∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀溶解平衡,它们都可看作化学平衡。请根据所学知识回答下列问题:
(1)AlCl3溶液呈______性(填“酸”“中”“碱”)原因是_________________________(用离子方程式表示);若把AlCl3溶液蒸干,灼烧,最后主要得到固体产物是________;若将AlCl3溶液和NaHCO3溶液混合,该反应的离子方程式为__________________________________________。
(2)将1L0.2 mol·L-1HA溶液与1L0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中c(Na+)>c(A-),则:
①混合溶液中,c(A-)________c(HA)(填“>”“<”或“=”,下同)。
②混合溶液中,c(HA)+c(A-)________0.1 mol·L-1。
(3)常温下,若NaOH溶液中c(OH—)与NH4Cl溶液中c(H+)相同,现将NaOH溶液和NH4Cl溶液分别稀释10倍,稀释后NaOH溶液和NH4CI溶液的pH分别用pH1和pH2表示。则pH1 +pH2________(填“>”“<”或“=”)14。
(4)pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中书写正确的是( )
A.碳酸氢钙溶液跟盐酸反应:HCO3-+H+=H2O+CO2↑
B.氯气跟水反应:Cl2+H2O=2H++Cl-+ClO-
C.碳酸氢钠溶液和氢氧化钙溶液混合HCO3-+OH-=CO32-+H2O
D.碳酸钠溶液中滴加少量盐酸CO32-+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学用实验室中一瓶久置的NaOH固体做了以下实验:先称取13.3 g NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入浓度为4 mol/L的盐酸,再根据生成CO2的体积计算出Na2CO3的质量,从而进一步计算出样品中变质NaOH的质量
请回答下列问题:
(1)该实验的目的是_________________
(2)已知20 ℃时,Na2CO3溶解度为21.7 g ,NaOH溶解度为108.3 g若要将所称取的样品恰好溶解,最多需要蒸馏水____________g,溶解样品所需的仪器是________________
(3)实验测得加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
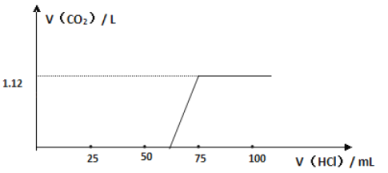
则13.3 g 该样品中未变质的NaOH的质量为____________;NaOH的变质程度为_________(用质量分数表示);与NaOH反应消耗的盐酸体积为________mL
(4)根据“与NaOH反应消耗盐酸的体积”,并对照上述图像,他们从实验中还发现了什么问题?_____________________,并由此得出了什么结论?____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,在体积为VL的固定容积的容器中发生反应:A(g)+B(g)![]() 3C(g)(正反应为放热反应)下列说法能说明该反应已经达到平衡状态的是( )
3C(g)(正反应为放热反应)下列说法能说明该反应已经达到平衡状态的是( )
①单位时间内生成C的分子数与分解C的分子数相等②外界条件不变时,ABC的浓度不随时间变化③体系温度不再变化④体系的分子总数不再变化 ⑤反应速率3v(B)=v(C)
A.①②B.①②③
C.①②③④D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据媒体报道,日本食品巨头明治公司生产的“明治STEP”奶粉中检测出含量超标的放射性元素铯(Cs)。铯较为稳定的核素有![]() 、
、![]() 、
、![]() 、
、![]() 。下列判断不正确的是( )
。下列判断不正确的是( )
A. ![]() 、
、![]() 、
、![]() 、
、![]() 互为同位素
互为同位素
B. ![]() 、
、![]() 、
、![]() 、
、![]() 的核外电子排布相同
的核外电子排布相同
C. ![]() 、
、![]() 、
、![]() 、
、![]() 的性质和用途相同
的性质和用途相同
D. ![]() 、
、![]() 、
、![]() 、
、![]() 的质量数和中子数均不同
的质量数和中子数均不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. Na2O2遇到湿润的紫色石蕊试纸后,石蕊试纸最终变成蓝色
B. Na2O2与CO2反应生成0.1 mol O2时转移电子0.4 mol
C. Na2O2投入到CuCl2溶液中有蓝色沉淀及气泡产生
D. 向饱和烧碱溶液中加入2 g Na2O2,充分反应完后,溶液中c(Na+)不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com