
【题目】据媒体报道,日本食品巨头明治公司生产的“明治STEP”奶粉中检测出含量超标的放射性元素铯(Cs)。铯较为稳定的核素有![]() 、
、![]() 、
、![]() 、
、![]() 。下列判断不正确的是( )
。下列判断不正确的是( )
A. ![]() 、
、![]() 、
、![]() 、
、![]() 互为同位素
互为同位素
B. ![]() 、
、![]() 、
、![]() 、
、![]() 的核外电子排布相同
的核外电子排布相同
C. ![]() 、
、![]() 、
、![]() 、
、![]() 的性质和用途相同
的性质和用途相同
D. ![]() 、
、![]() 、
、![]() 、
、![]() 的质量数和中子数均不同
的质量数和中子数均不同
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】我国科研人员以Zn和尖晶石型锰酸锌(ZnMn2O4)为电极材料,研制出一种水系锌离子电池。该电池的总反应方程式:xZn + Zn1xMn2O4![]() ZnMn2O4(0 < x < 1)。下列说法正确的是
ZnMn2O4(0 < x < 1)。下列说法正确的是
A. 充电时,Zn2+向ZnMn2O4电极迁移
B. 充电时,阳极反应:ZnMn2O4 2xe—=Zn1-xMn2O4+xZn2+
C. 放电时,每转移1mol e-,ZnMn2O4电极质量增加65g
D. 充放电过程中,只有Zn元素的化合价发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①液态HCl ②NaHCO3 ③NaCl溶液 ④CO2 ⑤蔗糖晶体 ⑥Ba(OH)2 ⑦红褐色的氢氧化铁胶体 ⑧NH3H2O ⑨空气 ⑩Al2(SO4)3
(1)上述十种物质中有两种物质在水溶液中可发生反应,离子方程式为:H++OH-=H2O,该反应的化学方程式为______________________________________。
(2)②在水中的电离方程式为______________________________。
(3)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能治疗胃酸过多,请写出其反应的离子方程式_________________;如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,此时最好用含Al(OH)3的胃药(如胃舒平),它与胃酸反应的离子方程式________。
(4)写出下列反应的离子方程式:
向Ba(OH)2溶液中逐滴加入硫酸溶液___________________________。
向Ba(OH)2溶液中通入过量的CO2_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置进行实验,根据实验现象填表:
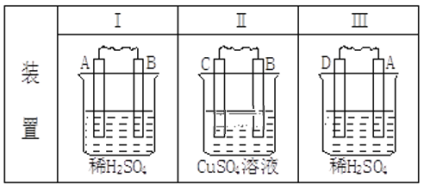
现象 | (I)金属A逐渐溶解 | (Ⅱ)C的质量增加 | (Ⅲ)A上有气体产生 |
填正极反应式 | ___ | ___ | |
四种金属活动性由强到弱的顺序:___。 | |||
若装置(Ⅲ)中A极产生的气体在标准状况下的体积为224mL,则通过导线中的电子的物质的量为___mol。 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中通常加热无水乙醇与浓硫酸的混合物的方法制取乙烯,在具体的化学实验中常因加热的温度过高导致副反应发生而使乙烯气体中混有二氧化硫气体,有人设计下列实验以确认乙烯气体中混有二氧化硫气体。请回答下列问题:
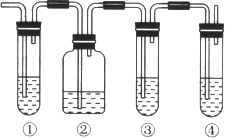
(1) 图中①和④的容器内盛放的化学试剂分别是(填写代号)
①_____________________、④_________________________。
A.品红溶液 B.烧碱溶液 C.浓硫酸 D.酸性高锰酸钾溶液
(2)能说明二氧化硫气体存在的现象是____________________________________________。
(3)使用装置②的目的是______________________;使用装置③的目的是__________________。
(4)确认乙烯气体存在的现象是_____________________________________________________。
(5)确认乙烯气体的存在还可用溴水,请写出乙烯与溴水反应的方程式_________________;其反应类为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲使1L1.0mol·L-1 NaOH溶液的浓度增大一倍,可采取的合理措施是( )
A.加入40g固体NaOH,搅拌、溶解
B.将溶液取出500mL
C.加入1L3.0mol·L-1的NaOH溶液混合均匀
D.加入5mol·L-1NaOH溶液1L,再加水稀释至3L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雄黄 (As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为______。
(2)上述反应中的氧化剂是_____,反应产生的气体可用____吸收。
(3)As2S3和HNO3有如下反应:As2S3 + 10H+ + 10NO3- = 2H3AsO4+ 3S+10NO2↑+ 2H2O,若生成2mol H3AsO4,则反应中转移电子的物质的量为____。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量_____(填字母)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料。如图是一套制取并验证氯气部分化学性质的实验装置。已知:Cl2+2KI=I2+2KCl。
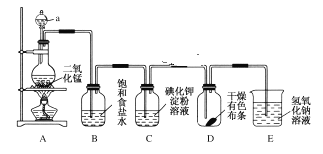
(1)写出实验室制取氯气反应的化学方程式___。
(2)装置B的作用是___。
(3)当有少量Cl2通过后,观察到装置C中溶液变成___色。
(4)当Cl2持续通过时,装置D中干燥的有色布条能否褪色?为什么?__。
(5)若要证明Cl2无漂白性,则必须在装置D之前加一个装有__的洗气瓶。
(6)装置E的作用是__,该反应的离子方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com