
【题目】某化学兴趣小组同学用实验室中一瓶久置的NaOH固体做了以下实验:先称取13.3 g NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入浓度为4 mol/L的盐酸,再根据生成CO2的体积计算出Na2CO3的质量,从而进一步计算出样品中变质NaOH的质量
请回答下列问题:
(1)该实验的目的是_________________
(2)已知20 ℃时,Na2CO3溶解度为21.7 g ,NaOH溶解度为108.3 g若要将所称取的样品恰好溶解,最多需要蒸馏水____________g,溶解样品所需的仪器是________________
(3)实验测得加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
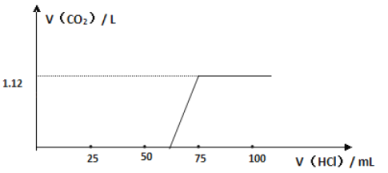
则13.3 g 该样品中未变质的NaOH的质量为____________;NaOH的变质程度为_________(用质量分数表示);与NaOH反应消耗的盐酸体积为________mL
(4)根据“与NaOH反应消耗盐酸的体积”,并对照上述图像,他们从实验中还发现了什么问题?_____________________,并由此得出了什么结论?____________________________
【答案】测定NaOH的变质程度 61.3 烧杯玻璃棒量筒 8.00g 33.3% 50.0 NaOH被盐酸中和后继续滴加盐酸未立即产生气体 CO32-与盐酸的反应分步进行的
【解析】
(1)依据题干:计算出样品中变质NaOH的质量可知实验目的;
(2)已知20℃时,Na2CO3溶解度为21.7g,NaOH溶解度为108.3g,所以依据碳酸钠的溶解度计算需要水的质量;溶解固体需要的仪器:烧杯、玻璃杯、量筒;
(3)根据盐酸与碳酸钠反应的化学方程式和生成的二氧化碳的质量,列出比例式,就可计算出该样品中Na2CO3的质量,进而计算氢氧化钠的质量和变质程度;
(4)依据图象可知,NaOH被盐酸中和后继续滴加盐酸未立即产生气体,可知碳酸根离子与盐酸反应,先生成碳酸氢根离子,碳酸氢根离子再与盐酸反应生成二氧化碳,据此分析。
(1)依据题干可知,实验目的为:测定NaOH的变质程度;
(2)已知20℃时,Na2CO3溶解度为21.7g,NaOH溶解度为108.3g;若要将所称取的样品恰好溶解,设最多需要蒸馏水mg,则:21.7:100=13.3:m,解得m=61.3g;溶解固体需要的仪器:烧杯、玻璃杯、量筒;
(3)设该样品中Na2CO3的质量是x,
2HCl+Na2CO3=2NaCl+H2O+CO2↑
106 44
x 2.2g
∴106:44=x:2.2g,
解之得:x=5.3g,则NaOH的质量=13.3g-5.3g=8g;
则由碳酸钠的质量为5.3g,设反应的氢氧化钠的质量为z;
2NaOH+CO2═Na2CO3+H2O
80 106
z 5.3g
![]() =
=![]() ,解:z=4g,变质程度为:
,解:z=4g,变质程度为:![]() ×100%=33.3%;
×100%=33.3%;
氢氧化钠物质的量为:![]() =0.2mol,依据HCl~NaOH,可知消耗盐酸的物质的量为:0.2mol,与NaOH反应消耗的盐酸体积为:
=0.2mol,依据HCl~NaOH,可知消耗盐酸的物质的量为:0.2mol,与NaOH反应消耗的盐酸体积为:![]() =0.05L,即50mL;
=0.05L,即50mL;
(4)依据图象可知,NaOH被盐酸中和后继续滴加盐酸未立即产生气体,可知碳酸根离子与盐酸反应,先生成碳酸氢根离子,碳酸氢根离子再与盐酸反应生成二氧化碳,得出结论:碳酸根离子与盐酸的反应是分步进行的。


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。高铁酸钾为暗红色粉末状晶体,干燥的晶体80℃以下十分稳定,它极易溶于水,难溶于异丙醇。实验室模拟生产工艺流程如图:
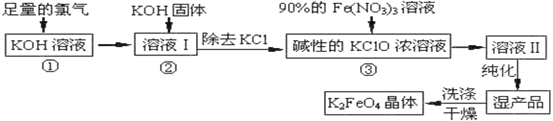
已知:①2KOH+Cl2=KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2=5KCl+KClO3+3H2O(条件:温度较高)
③K2FeO4在水溶液中易水解:4FeO42-+10H2O![]() 4Fe(OH)3(胶体)+8OH-+3O2↑
4Fe(OH)3(胶体)+8OH-+3O2↑
回答的下列问题:
实验室可以利用如图装置完成流程①和②
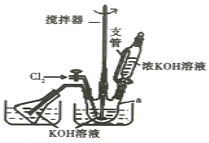
(1)恒压滴液漏斗支管的作用是_____,两水槽中的水为____(填“热水”或“冷水”)。
(2)反应一段时间后,停止通氯气,再往仪器a中加入浓KOH溶液的目的是______;判断浓KOH溶液已过量的实验依据是___。
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为____。
(4)用重结晶法提纯粗产品:将粗产品先用KOH稀溶液溶解,再加入饱和KOH溶液,冷却结晶,过滤,用少量异丙醇洗涤,最后低温真空干燥。
①粗产品用KOH溶解的目的是_____。
②如何判断K2FeO4晶体已经洗涤干净____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配平方程式 KMnO4+ HCl(浓)- KCl+ MnCl2+ Cl2↑+ H2O,并用双线法分析此反应;___。
(2)指出___是氧化剂,___元素被氧化,氧化产物是___,此反应中,HCl表现的性质有___性和___性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础。下列关于各实验装置的叙述正确的是( )

A. 装置①常用于分离互不相溶的液体混合物
B. 装置②可用于吸收NH3或HCl气体,并防止倒吸
C. 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
D. 装置③可用于收集H2、CO2、Cl2、NH3等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①液态HCl ②NaHCO3 ③NaCl溶液 ④CO2 ⑤蔗糖晶体 ⑥Ba(OH)2 ⑦红褐色的氢氧化铁胶体 ⑧NH3H2O ⑨空气 ⑩Al2(SO4)3
(1)上述十种物质中有两种物质在水溶液中可发生反应,离子方程式为:H++OH-=H2O,该反应的化学方程式为______________________________________。
(2)②在水中的电离方程式为______________________________。
(3)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能治疗胃酸过多,请写出其反应的离子方程式_________________;如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,此时最好用含Al(OH)3的胃药(如胃舒平),它与胃酸反应的离子方程式________。
(4)写出下列反应的离子方程式:
向Ba(OH)2溶液中逐滴加入硫酸溶液___________________________。
向Ba(OH)2溶液中通入过量的CO2_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中盛有N2和H2,它们的起始浓度分别是1.8 mol /L和5.4 mol /L,在一定的条件下它们反应生成NH3,10 min后测得N2的浓度是0.8 mol /L,则在这10 min内用NH3来表示的平均反应速率是
A.0.1 mol /(L·min)B.0.2 mol /(L·min)
C.0.3 mol /(L·min)D.0.6 mol /(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置进行实验,根据实验现象填表:
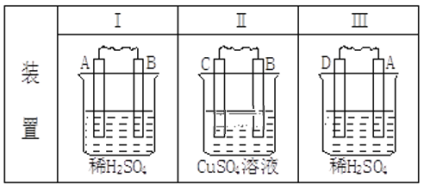
现象 | (I)金属A逐渐溶解 | (Ⅱ)C的质量增加 | (Ⅲ)A上有气体产生 |
填正极反应式 | ___ | ___ | |
四种金属活动性由强到弱的顺序:___。 | |||
若装置(Ⅲ)中A极产生的气体在标准状况下的体积为224mL,则通过导线中的电子的物质的量为___mol。 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲使1L1.0mol·L-1 NaOH溶液的浓度增大一倍,可采取的合理措施是( )
A.加入40g固体NaOH,搅拌、溶解
B.将溶液取出500mL
C.加入1L3.0mol·L-1的NaOH溶液混合均匀
D.加入5mol·L-1NaOH溶液1L,再加水稀释至3L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国女药学家屠呦呦因成功提取青蒿素而获得2015年诺贝尔医学奖,有关青蒿素的结构如图所示,下列关于靑蒿素的推断,不合理的是( )
A. 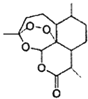 青蒿素的分子式是
青蒿素的分子式是![]()
B. 青蒿素所有碳原子均在同一平面上
C. 青蒿素在碱性条件下不能稳定存在
D. 青蒿素可以发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com