
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. Na2O2遇到湿润的紫色石蕊试纸后,石蕊试纸最终变成蓝色
B. Na2O2与CO2反应生成0.1 mol O2时转移电子0.4 mol
C. Na2O2投入到CuCl2溶液中有蓝色沉淀及气泡产生
D. 向饱和烧碱溶液中加入2 g Na2O2,充分反应完后,溶液中c(Na+)不变
查看答案和解析>>
科目: 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂,常见制备方法如下。
(1)氯酸钾氧化法:化学反应方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KC1+3C12,每生成3mol KH(IO3)2,反应中转移的电子数为______,向反应后溶液中加______溶液得到KIO3。
(2)一种由含碘废水制取碘酸钾的工艺如图:

①进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤液中可通过滴加______盐溶液来检验其是否已洗涤干净。
②“制FeI2”时,发生反应的化学方程式为______。
③在KIO3、KHSO3的酸性混合溶液中加入少量KI(催化剂)和淀粉,不停地搅拌,反应机理为:第一步IO3-+5I-+6H+=3I2+3H2O第二步反应的离子方程式为______。
当反应进行到1.5min时,溶液突然变为蓝色,随之又很快消失,则第______步反应速率快。
④改变反应温度,重复上述实验,得到温度(T)与溶液变蓝所需时间(t)的关系如图所示(超过50℃后溶液不会再变蓝)。根据图象,请你分析温度低于50℃时,溶液变蓝所需时间与反应温度的关系:_________。

(3)山东省已下调食用盐碘含量标准每千克盐含碘25毫克(波动范围为18~33mgkg-1)。测定食盐试样中碘元素含量的步骤如下:称取4.000g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00mL6.000×10-4molL-1Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-。计算该食盐试样中碘元素的含量______mgkg-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A是一种能使红色石蕊试液变蓝的气体,甲为淡黄色固体化合物,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化,用两根玻璃棒分别蘸取化合物A、G的浓溶液并使它们接近,有大量白烟生成。请回答下列问题:
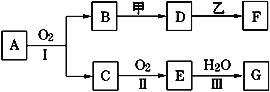
(1)写出甲的电子式是___________;
(2)写出反应Ⅰ的化学方程式__________;
(3)A溶于水得到溶液X,在25℃下,将a mol·L-1的X与b mol·L-1的G溶液等体积混合,溶液显中性,则所得溶液中离子浓度由大到小的顺序为______________;用含a和b的代数式表示出该混合溶液中X的电离平衡常数_______________________。
(4)工业上采用的一种污水处理方法是:保持污水的pH在5.0~6.0之间,通过如图装置处理污水。
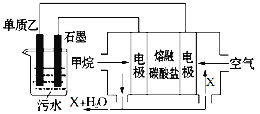
① 电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是:Ⅰ.___; Ⅱ.______。
② 为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分X物质参加循环,X物质的化学式是_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于某些离子的检验及结论一定正确的是
A. 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO![]()
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO![]()
C. 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH![]()
D. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如下反应关系。
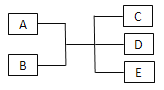
(1)若A是一种红色金属单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,反应的离子方程式为___________,若反应放出1.12 L气体(标准状况下),则被还原的B物质的量为___________mol。
(2)若实验室中利用固体A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小、碱性的气体,试写出此反应的化学方程式________________;实验室检验C的方法为_______________。
(3)若B是黄绿色有毒气体,上述关系经常用于实验室尾气处理,则反应的离子方程式为________________。若用湿润的淀粉碘化钾试纸靠近盛满B的试管口,看到的现象为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用固体烧碱配制0.1mol/L的NaOH溶液480mL,请回答:
(1)计算需要NaOH固体质量______g;
(2)有以下仪器:①烧杯②药匙 ③250mL容量瓶④500mL容量瓶⑤玻璃棒⑥托盘天平⑦量筒.配制时,必须使用的玻璃仪器______(填序号),还缺少的仪器是______;
(3)使用容量瓶前必须进行的一步操作是______;
(4)配制溶液时,在计算、称量、溶解、冷却后还有以下几个步骤,其正确的操作顺序为______(填序号);
①振荡摇匀;②洗涤;③定容;④颠倒摇匀;⑤转移
(5)配制过程中,下列操作会引起结果偏高的是______(填序号);
①未洗涤烧杯、玻璃棒;
②称量NaOH的时间太长;
③定容时俯视刻度;
④容量瓶不干燥,含有少量蒸馏水;
⑤NaOH溶液未冷却至室温就转移到容量瓶.
(6)某同学用浓硫酸配制的稀硫酸浓度偏低,则可能的原因是______(填序号)。
①用量筒量取浓硫酸时,仰视刻度线
②容量瓶用蒸馏水洗涤后未经干燥
③洗涤烧杯内壁后将洗涤液弃去
④转移溶液时,不慎有少量溶液洒出
⑤定容时,俯视容量瓶刻度线
⑥定容、摇匀后发现溶液的凹液面低于刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】阿伏加德罗常数的近似值为6.02×1023.按要求完成下列填空:
(1)1molCl2中约含有______个氯气分子,约含有______个氯原子,含有6.02×1023个氢原子的H2SO4的物质的量是______;
(2)标准状况下11.2LN2O4和______molNO所含有的原子数相等。
(3)某硫酸钠溶液中含有3.01×1023个Na+,则该溶液中SO42-的物质的量是______。
(4)2L1mol/LMgCl2中镁离子的物质的量为______,Cl-的物质的量浓度为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 在粗硅的制取中发生2C+SiO2![]() 2CO↑+Si,硅被还原,所以碳的还原性强于硅的还原性
2CO↑+Si,硅被还原,所以碳的还原性强于硅的还原性
B. 盛放NaOH溶液时,使用带玻璃塞的磨口瓶
C. 用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2
D. 由Na2CO3+SiO2![]() Na2SiO3+CO2↑可知,硅酸的酸性强于碳酸
Na2SiO3+CO2↑可知,硅酸的酸性强于碳酸
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是
A. 金属铜与硝酸银溶液反应:Cu+Ag+ =Cu2++Ag
B. Ba(OH)2溶液和H2SO4溶液反应:Ba2+ + OH- + H+ + SO42- = BaSO4↓+ H2O
C. 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
D. 石灰乳与盐酸反应:Ca(OH)2+2H+ = Ca2++2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com