
科目: 来源: 题型:
【题目】铁及其化合物在日常生活中应用广泛。
(1)取5.6 g的生铁与足量的稀硫酸混合反应,无论怎样进行实验,最终收集的气体体积均小于2.24 L(标准状况),最主要的原因是____________________________;所得溶液在长时间放置过程中会慢慢出现浅黄色,试用离子方程式解释这一变化的原因:________________________________。
(2)氧化铁是重要的工业颜料,下面是制备氧化铁的一种方法(铁屑表面常附着油污),其流程如下:
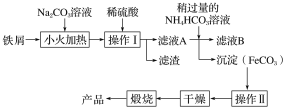
①操作Ⅰ的名称是________;操作Ⅱ为洗涤,洗涤操作的具体方法为__________________。
②滤液A中加入稍过量的NH4HCO3溶液,生成沉淀的同时有一种气体(能使澄清石灰水变浑浊)产生,写出其化学方程式: __________________________________。
(3)如果煅烧不充分,产品中将有FeO存在,称取3.0 g氧化铁产品,加酸溶解,在250 mL容量瓶中定容;量取25.00 mL待测溶液于锥形瓶中,用酸化的0.010 00 mol·L-1 KMnO4溶液滴定至终点,重复滴定2~3次,消耗酸性KMnO4溶液体积的平均值为20.00 mL。
①该实验中的KMnO4溶液需要酸化,用于酸化的酸是________(填序号)。
a.硝酸 b.盐酸 c.硫酸
②上述产品中Fe2O3的质量分数为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 溶液呈电中性,胶体带电荷。
B. 配制0.1 mol·L-1CuSO4溶液100 mL,称取1.6g硫酸铜晶体
C. 向饱和Ca(OH)2溶液中加入少量无水CaO固体,恢复原温度,溶液中Ca(OH)2的物质的量浓度不变
D. 制备Fe(OH)3胶体,可向沸水中滴加FeCl3饱和溶液并长时间煮沸
查看答案和解析>>
科目: 来源: 题型:
【题目】分类是科学研究的重要方法,下列物质分类正确的是( )
A. 非电解质:乙醇、氯气B. 酸性氧化物:NO、![]()
C. 胶体:豆浆、葡萄糖溶液D. 离子化合物:NaH、![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】在最新的家用汽车的调查中发现,新车中气体的质量不符合标准.汽车污染主要来源于汽车配件及材料,它们都会产生大量的有毒有机物.其中一种有毒物质A,为了测定有机物A的结构,做如下实验:
①将9.2g该有机物完全燃烧,生成标况下15.68L的CO2和7.2g水;
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;
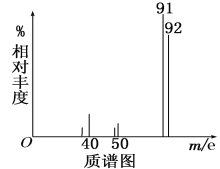
(1)则由图可知该分子的相对分子质量是________,有机物A的分子式为_________。
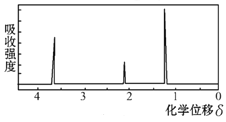
(2)用核磁共振仪处理该化合物,得到如下图所示图谱,图中四个峰的面积之比是1∶2∶2:3,则有机物的名称为________,其苯环上的一氯代物有_______种。若将有机物A与氢气完全加成,则加成后的有机物的一氯代物共有________种。
查看答案和解析>>
科目: 来源: 题型:
【题目】在0.24 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。
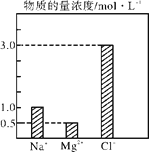
(1)该混合液中,NaCl的物质的量为______mol,含溶质MgCl2的质量为________g。
(2)该混合液中CaCl2的物质的量为________mol,将该混合液加水稀释至体积为1200mL,稀释后溶液中Ca2+的物质的量浓度为______mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)与16gO2所含原子总数相同的NH3标准状况下体积是________L;
(2)已知2LAl2(SO4)3溶液中c(Al3+)=3mol/L,则c(SO42-)=__________,与3L__________mol/LNa2SO4中SO42-的物质的量浓度相等。
(3)同温同压下,同体积的NH3和H2S气体的质量比为_____________;同质量的NH3和H2S气体的体积比为___________;若二者氢原子数相等,它们的体积比为____________。
(4)在标准状况下,8.96L的CH4和CO的混合气体,混合气体对氢气相对密度是9.5,混合气体平均摩尔质量为__________,混合气体中CH4的体积为__________,一氧化碳的质量分数为__________,二者原子个数比为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定质量的Mg和Al的混合物投入500 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。则下列说法正确的是( )

A.Mg和Al的总质量为8 g
B.原稀硫酸溶液的物质的量浓度为5 mol·L-1
C.生成的H2在标准状况下的体积为11.2 L
D.NaOH溶液的物质的量浓度为5 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学—选修5 有机化学基础】某抗结肠炎药物有效成分的合成路线如下(部分反应略去试剂和条件):
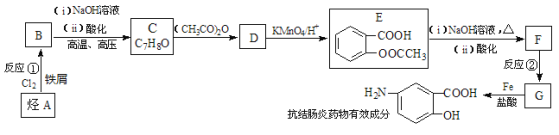
已知:
请回答下列问题:
(1)抗结肠炎药物有效成分的分子式是:_____________;烃A的名称为:_____________;反应②的反应类型是:___________________。
(2)①下列对该抗结肠炎药物有效成分可能具有的性质推测正确的是:____________;
A.水溶性比苯酚好 B.能发生消去反应也能发生聚合反应
C.1mol该物质最多可与4mol H2发生反应 D.既有酸性又有碱性
② E与足量NaOH溶液反应的化学方程式是:_______________________。
(3)符合下列条件的抗结肠炎药物有效成分的同分异构体有________种。
A.遇FeCl3溶液有显色反应 B.分子中甲基与苯环直接相连 C.苯环上共有三个取代基
(4)已知:苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位,据此按先后顺序写出以A为原料合成邻氨基苯甲酸(![]() )合成路线中两种中间产物的结构简式(部分反应条件已略去)
)合成路线中两种中间产物的结构简式(部分反应条件已略去)
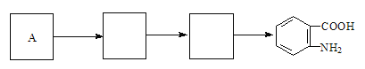
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学需用480 mL 0.5 mol·L-1Na2CO3溶液,在实验室进行配制。
I.(1)该同学用托盘天平应称量________g Na2CO3粉末,使用容量瓶前必须进行的一步操作是______。
(2)下图是该同学配制的一些关键步骤和操作图。
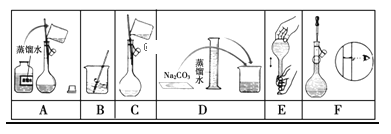
配制过程的先后顺序为(用字母A~F填写)________________。
Ⅱ.若配制1mol/L的稀硫酸溶液500mL
(1)则需要质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为___________mL(计算结果保留一位小数)。如果实验室有10mL 、25mL、50mL量筒,应选用_____________mL规格的量筒最好。
(2)下面操作造成所配稀硫酸溶液浓度偏高的是(_____)
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线.
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.如图1所示是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
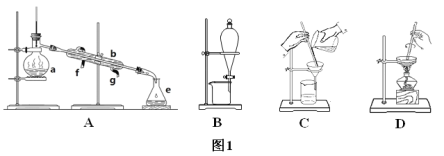
(1)从氯化钾溶液中得到氯化钾固体选择装置___(填代表装置图的字母,下同);除去自来水中的氯离子等杂质选择装置____。
(2)从碘水中分离出I2选择装置_____,该分离方法的名称为____。
(3)装置A中仪器a的名称是_____,进水的方向是____。
Ⅱ.海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如图2流程的实验:

(1)粗盐中含Ca2+、Mg2+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有: ①加入过量的Na2CO3溶液②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④加入盐酸调节溶液至中性;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是(填写序号字母)______。
a.⑤②③①④⑥⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
(2)由海水到氯化钠晶体的实验过程中要用到的主要装置是(从图1中给定的四种装置中选择)____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com