
科目: 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
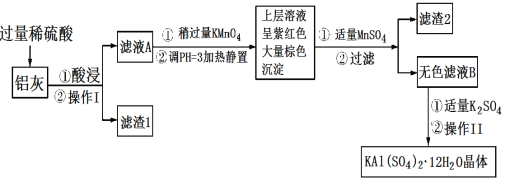
(1)明矾净水的原理是______________(用离子方程式表示)。
(2)操作Ⅰ是________,操作Ⅱ是蒸发浓缩、__________、过滤、洗涤、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是__________(只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是__________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+):_______。
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________,滤渣2含有的物质是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】同分异构现象在有机化学中是非常普遍的,下列有机化合物不是同分异构体的一组是( )
①CH2=CHCH3②![]() ③CH3CH2CH3④CH3CH2CH=CH2⑤
③CH3CH2CH3④CH3CH2CH=CH2⑤![]() ⑥CH3CH=CHCH3
⑥CH3CH=CHCH3
A. ①和②
B. ①和③
C. ④和⑥
D. ⑤和⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=______________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越________。
(2)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=________(可用分数表示)。
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号)________。
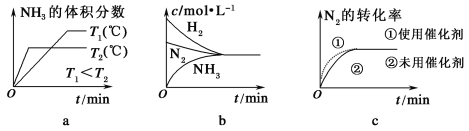
(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a________b(填“>”、“=”或“<”,下同),Q1________Q2,Q1________92.4。
查看答案和解析>>
科目: 来源: 题型:
【题目】图(甲)是实验室用氢气还原氧化铜实验的微型快速实验装置.其中的粗铜丝“Ⅰ”可以在试管M中上下移动,实验前先将铜丝“Ⅰ”处理成下端弯曲的一小圆环,并用铁锤击成带小孔的小匙,虚线框中需连入图(乙)(仪器上下端位置固定)的某装置进行实验.图乙中的细铜丝“Ⅱ”一端被弯成螺旋状。
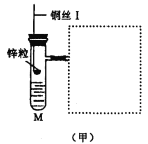
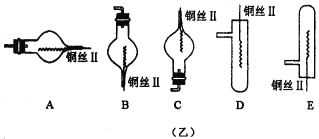
(1)在图甲中,试管M中的液体应选用_________________。
(2)在图示的虚线框中应连入的最合适的装置是___________(填代号)。
(3)上述制氢气的方法与将锌粒直接加入试管中相比,其优点有(写两点):__________________;________________ 。
(4)实验时,细铜丝“Ⅱ”的操作方法是_____________________________________________
(5)若实验室无粗铜丝,而改用无锈粗铁丝,为让其反复使用,则此时M中的液体应该是______________________,可用______________代替锌粒(写化学式), 发生反应的离子方程式为: _________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】以烯烃为原料,合成某些高聚物的路线如下:
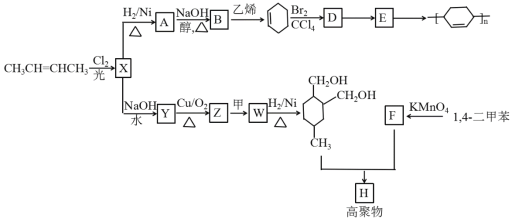
已知:Ⅰ.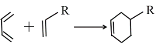 (R代表取代基或氢);
(R代表取代基或氢);
Ⅱ.甲为烃;Ⅲ.F能与NaHCO3反应产生CO2;请完成以下问题:
(1)CH3CH=CHCH3的名称是_________,X中官能团的名称是______________。
(2)A→B的化学方程式是________________________________________。
(3)D→E的反应类型为:______。
(4)下列有关说法正确的是_________。
a.有机物Y与HOCH2CH2OH互为同系物
b.有机物Z能发生银镜反应
c.有机物Y的沸点比B低
d.有机物F能与己二胺缩聚成聚合物
(5)写出Z→W的化学方程式:____________________。
(6)Y的同分异构体中,含有酯基的有______种。
(7)高聚物H的结构简式是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,已知Cu3P中P为-3价,则15molCuSO4可氧化的P的物质的量为
A. 1.5mol B. 5.5mol C. 3mol D. 2.5mol
查看答案和解析>>
科目: 来源: 题型:
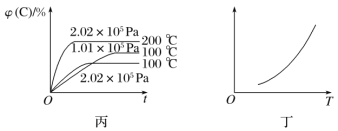
【题目】如图所示,甲、乙、丙分别表示在不同条件下可逆反应A(g)+B(g)![]() xC(g)的生成物C在反应混合物中的体积分数和反应时间的关系。
xC(g)的生成物C在反应混合物中的体积分数和反应时间的关系。
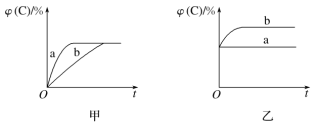
(1)若甲图中两条曲线分别代表有催化剂和无催化剂的情况,则________曲线表示无催化剂时的情况,反应速率:a________(填“大于”“小于”或“等于”)b。
(2)若乙图表示反应达到平衡后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入氦气后的情况,则________曲线表示恒温恒容的情况,在恒温恒容条件下,C的体积分数________(填“变大”“变小”或“不变”)。
(3)根据丙图可以判断该可逆反应的正反应是________(填“放热”或“吸热”)反应,化学计量数x的取值范围是______________。
(4)丁图表示在某固定容积的密闭容器中,上述可逆反应达到平衡后,某物理量随着温度(T)的变化情况。根据你的理解,丁图的纵轴可以是________________(填序号)。①φ(C)/%、②A的转化率、③B的转化率、④压强、⑤c(A)、⑥c(B);
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,容积为2 L的密闭容器中,将2 mol L气体和3 mol M气体混合,发生如下反应:2L(g)+3M(g) ![]() xQ(g)+3R(g),10 s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
xQ(g)+3R(g),10 s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
(1)10 s末L的物质的量浓度为________。
(2)前10 s内用M表示的化学反应速率为________。
(3)化学方程式中x值为________。
(4)在恒温恒容条件下,往容器中加入1 mol氦气,反应速率________(填“增大”、“减小”或“不变”,下同)。
(5)在恒温恒压条件,往容器中加入1 mol氦气,反应速率________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,已知两瓶容积相同,同温同压下,左瓶内充满氯化氢气体,当右瓶中充满下列混合气体中的某一组时,其所含原子总数与左瓶中所含原子总数一定相等,则该混合气体是( )

A. O3、N2 B. CH4、NH3 C. N2、O2 D. CO、CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】
深井岩盐的主要配料为:精制盐、碘酸钾(KIO3)、亚铁氰化钾[K4Fe(CN)6·3H2O]。其中亚铁氰化钾的无水盐在高温下会发生分解:3K4[Fe(CN)6]![]() 2(CN)2↑+12KCN+N2↑+Fe3C+C
2(CN)2↑+12KCN+N2↑+Fe3C+C
请回答下列问题:
(1)①Fe2+基态核外电子排布式为_____。
②![]() 的空间构型为______(用文字描述)。
的空间构型为______(用文字描述)。
③(CN)2分子中碳原子杂化轨道类型为_______,一种与CN-互为等电子体的分子的电子式为_______。
④1molFe(CN)63中含有σ键的数目为____mol。
(2)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=___。Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于____(填晶体类型)。
(3)如图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,则该立方体是不是Fe3O4的晶胞______(填“是”或“否”),立方体中三价铁离子处于氧离子围成的________(填空间结构)空隙。
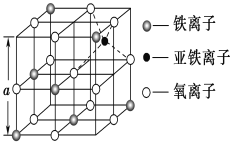
(4)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71gcm﹣3,晶胞边长为4.28×10﹣10 m,则FexO中x=____。(用代数式表示,不要求算出具体结果)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com