
【题目】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=______________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越________。
(2)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=________(可用分数表示)。
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号)________。
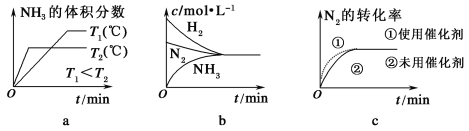
(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a________b(填“>”、“=”或“<”,下同),Q1________Q2,Q1________92.4。
【答案】![]() 小
小 ![]() a、c < < <
a、c < < <
【解析】
(1)①依据平衡常数概念和化学方程式书写平衡常数表达式,用生成物平衡浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积;
②反应是放热反应,升高温度后平衡逆向进行,平衡常数减小;
(2)依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到;
(3)a.先出现拐点的先达到平衡,则T2大,温度高,平衡逆向移动;
b.平衡时浓度不一定相等;
c.使用催化剂加快反应速率,对平衡无影响;
(4)恒压状态体积增大浓度减小,根据勒夏特列原理作答。
(1)①K为生成物浓度幂之积与反应物浓度幂之积的比,则该反应的平衡常数为:K=![]() ,
,
故答案为:![]() ;
;
②该反应为放热反应,升高温度,平衡逆向移动,则平衡常数K减小,温度越高,K越小,故答案为:小;
(2)设氮气消耗物质的量为x
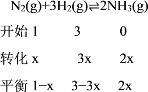 ,
,
平衡混合气体中氨的体积分数为20%,则有![]()
解得:x=![]() ,所以平衡常数
,所以平衡常数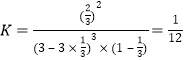
故答案为:![]() ;
;
(3)a.先出现拐点的先达到平衡,则T2大,温度高,平衡逆向移动,与图象一致,a项正确;
b.平衡时浓度不一定相等,平衡浓度取决起始浓度和转化率,图象表示错误,b项错误;
c.使用催化剂加快反应速率,对平衡无影响,平衡时物质的浓度不变,与图象一致,c项正确;
故答案为:a、c;
(4) 在恒压的情况下进行反应,达到虚线部位,然后恢复到原位置,体积增大浓度减小,根据勒夏特列原理平衡向逆反应方向进行,故a<b,Q1<Q2,合成氨是可逆反应,故Q1<92.4,
在恒压的情况下进行反应,达到虚线部位,然后恢复到原位置,体积增大浓度减小,根据勒夏特列原理平衡向逆反应方向进行,故a<b,Q1<Q2,合成氨是可逆反应,故Q1<92.4,
故答案为:<;<;<。


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】中学化学中下列各物质间不能实现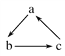 (“→”表示一步完成)转化的是
(“→”表示一步完成)转化的是
选项 | A | B | C | D |
a | CH3CH2OH | CH2=CH2 | Cl2 | C |
b | CH3CHO | CH3CH2Br | HClO | CO |
c | CH3COOH | CH3CH2OH | HCl | CO2 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)![]() 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是

A. t2时加入了催化剂 B. t3时降低了温度
C. t5时增大了压强 D. t4~t5时间内转化率一定最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用于提纯或分离物质的方法有:A、萃取分液 B、加热分解 C、蒸发结晶 D、分液 E、蒸馏 F、过滤 G、渗析等,请将提纯或分离的序号填在后面横线上。
(1)分离饱和食盐水与泥沙的混合物___,
(2)精制Fe(OH)3胶体![]() 含有NaCl溶液
含有NaCl溶液![]() ___,
___,
(3)分离相溶的CCl4(沸点为76.75℃)和甲苯(110.6℃)的混合物___,
(4)从碘水里提取碘____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,容积为2 L的密闭容器中,将2 mol L气体和3 mol M气体混合,发生如下反应:2L(g)+3M(g) ![]() xQ(g)+3R(g),10 s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
xQ(g)+3R(g),10 s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
(1)10 s末L的物质的量浓度为________。
(2)前10 s内用M表示的化学反应速率为________。
(3)化学方程式中x值为________。
(4)在恒温恒容条件下,往容器中加入1 mol氦气,反应速率________(填“增大”、“减小”或“不变”,下同)。
(5)在恒温恒压条件,往容器中加入1 mol氦气,反应速率________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 向含0. 1 mol Na2SiO3的溶液中滴加盐酸,生成的H2SiO3胶体中胶粒的数目为0.1NA
B. 常温常压下,1.8g甲基(—CD3)中含有的中子数为NA
C. 常温下,1L pH=10的氨水溶液中,发生电离的水分子数为1×10-10 NA
D. 7.8gNa2O2分别与过量的CO2和过量的SO2充分反应,转移的电子数目均为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏加德罗常数)
A.在常温常压下,11.2LN2含有的分子数为0.5NA
B.在常温常压下,1mol氦气含有的原子数为NA
C.71gCl2所含原子数为 NA
D.23g钠在化学反应中失去电子数目为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用气相还原法制备纳米级Fe,其流程如图所示:
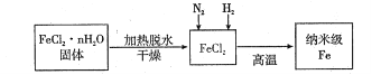
(1)纳米级Fe和稀盐酸反应的离子方程式为__________。
(2)如何将FeCl2·nH2O固体加热脱水制得无水FeCl2________(用简要文字描述)。
(3)生成纳米级Fe的化学方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的叙述中正确的是 ( )
A. pH=0的H2SO4溶液与1 mol·L-1 的Ba(OH)2溶液中水的电离程度相同
B. 0.2mol·L-1 CH3COOH溶液中的c(H+)是0.1mol·L-1 CH3COOH中的c(H+)的2倍
C. 室温时,pH=2的CH3COOH和0.01mol·L-1 NaOH溶液等体积混合,混合后pH=7
D. 等物质的量浓度的Na2S和NaHS的混合溶液中:2c(Na+)=3[c(S2-)+c(HS-)+c(H2S)]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com