
【题目】用于提纯或分离物质的方法有:A、萃取分液 B、加热分解 C、蒸发结晶 D、分液 E、蒸馏 F、过滤 G、渗析等,请将提纯或分离的序号填在后面横线上。
(1)分离饱和食盐水与泥沙的混合物___,
(2)精制Fe(OH)3胶体![]() 含有NaCl溶液
含有NaCl溶液![]() ___,
___,
(3)分离相溶的CCl4(沸点为76.75℃)和甲苯(110.6℃)的混合物___,
(4)从碘水里提取碘____。
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为0.65mol / L。现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2=KOCN+2KCl+H2O,该反应中被氧化的元素是 __________(写元素符号),氧化产物为_____________(写化学式)。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气(2KOCN+4KOH+3Cl2=2CO2↑+N2↑+6KCl+2H2O)。若反应转移120mol电子,则消耗0.1mol / LKOH_________L 。
(3)KClO3可用于实验室制O2,若不加催化剂,400℃时分解不生成O2只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1,写出该反应的化学方程式_____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各关系式中能说明反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
A. 3v正(N2)=v正(H2) B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3) D. v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室要配制500 mL 0.2 mol/L NaOH溶液,请回答下列问题:
(1)配制过程中不需要使用的化学仪器有________(填字母)。
A 烧杯 B 500 mL容量瓶 C 漏斗 D 胶头滴管 E 玻璃棒
(2)用托盘天平称取氢氧化钠,其质量为________ g。
(3)下列主要操作步骤的正确顺序是________(填序号)。
①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶瓶颈刻度线下1~2 cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③待冷却至室温后,将溶液转移到500 mL容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)如果实验过程中缺少步骤⑤,会使配制出的NaOH溶液浓度_______(填“偏高、偏低”或“不变”)。
Ⅱ.如图实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
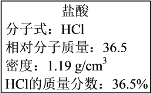
(1)该浓盐酸中HCl的物质的量浓度为______ mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是______。
A 溶液中HCl的物质的量 B 溶液的浓度
C 溶液中Cl-的数目 D 溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol/L的稀盐酸。该学生需要量取______mL上述浓盐酸进行配制。
Ⅲ.现有0.27Kg质量分数为10%的CuCl2溶液,则溶液中CuCl2的物质的量为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2 (g)+O2 (g)![]() 2SO3 (g) ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2 ;(丙) 2 mol SO3 。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
2SO3 (g) ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2 ;(丙) 2 mol SO3 。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A. 容器内压强p:p甲=p丙>2p乙
B. SO3的质量m:m甲=m丙>2m乙
C. c(SO2)与c(O2)之比为k:k甲=k丙>k乙
D. 反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
深井岩盐的主要配料为:精制盐、碘酸钾(KIO3)、亚铁氰化钾[K4Fe(CN)6·3H2O]。其中亚铁氰化钾的无水盐在高温下会发生分解:3K4[Fe(CN)6]![]() 2(CN)2↑+12KCN+N2↑+Fe3C+C
2(CN)2↑+12KCN+N2↑+Fe3C+C
请回答下列问题:
(1)①Fe2+基态核外电子排布式为_____。
②![]() 的空间构型为______(用文字描述)。
的空间构型为______(用文字描述)。
③(CN)2分子中碳原子杂化轨道类型为_______,一种与CN-互为等电子体的分子的电子式为_______。
④1molFe(CN)63中含有σ键的数目为____mol。
(2)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=___。Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于____(填晶体类型)。
(3)如图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,则该立方体是不是Fe3O4的晶胞______(填“是”或“否”),立方体中三价铁离子处于氧离子围成的________(填空间结构)空隙。
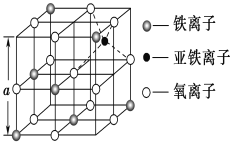
(4)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71gcm﹣3,晶胞边长为4.28×10﹣10 m,则FexO中x=____。(用代数式表示,不要求算出具体结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=______________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越________。
(2)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=________(可用分数表示)。
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号)________。
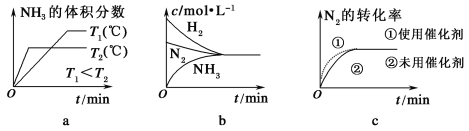
(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a________b(填“>”、“=”或“<”,下同),Q1________Q2,Q1________92.4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组用某种粗盐进行提纯实验,步骤如图所示:已知粗盐中含有的杂质离子主要为:Mg2+、Ca2+、Fe3+、SO42-。
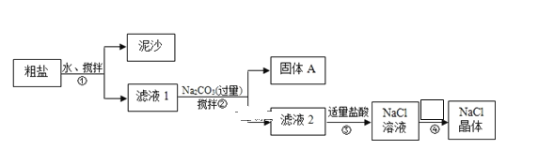
(1)步骤①和②的操作名称是___,所需要玻璃仪器为___。
(2)步骤②中在加入Na2CO3溶液之前还需加入过量NaOH溶液和BaCl2溶液,固体A是:___、___、Fe(OH)3 、BaSO4、BaCO3 (用化学式表示)
(3)步骤②中检验SO42-沉淀完全的操作是:___;
(4)步骤③中加入盐酸的作用是(用离子方程式表示)___;
(5)步骤④的操作为:___、过滤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工材料,二氧化硫与氧气反应生成三氧化硫是工业制硫酸的重要反应之一。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)![]() 2SO3(g)在一定条件下经20分钟达到平衡,测得c(SO3)=0.040mol/L。
2SO3(g)在一定条件下经20分钟达到平衡,测得c(SO3)=0.040mol/L。
①从反应开始到达到平衡,用SO2表示的平均反应速率为________________
②从平衡角度分析采用过量O2的目的是____________;
③该反应的平衡常数表达式为K=___________。
④已知:K(300℃)>K(350℃),该反应是________(选填“吸”或“放”)热反应。若反应温度升高,SO2的转化率将_______(填“增大”、“减小”或“不变”)。

(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”,下同)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com