
科目: 来源: 题型:
【题目】氯化亚砜(SOCl2)在科研和工业上应用比较广泛。回答下列问题:
I.工业上利用尾气SO2与SCl2、Cl2反应合成氯化亚砜。发生如下反应:
①Cl2(g)+SO2(g)![]() SO2Cl2(g) △H =-471.7kJmol-1
SO2Cl2(g) △H =-471.7kJmol-1
②SO2Cl2(g)+SCl2(g)![]() 2SOCl2(g) △H=-5.6kJmol-1
2SOCl2(g) △H=-5.6kJmol-1
567K时,在10L密闭容器中,充入一定量的Cl2、SO2和SCl2,测得初始压强为P0反应过程中容器内总压强(P)随时间(t)变化(反应达到平衡时的温度与起始温度相同)如图所示,起始各组分及达平衡时SO2Cl2(g)的物质的量如表。

各组分 | Cl2 | SO2(g) | SCl2(g) | SO2Cl2(g) | SOCl2(g) |
起始/mol | 0.5 | 0.5 | 0.5 | 0 | 0 |
平衡/mol | 0.2 |
(1)图中数据显示0~l min体系压强增大的原因是____。
(2)反应①、②达到平衡时,SCl2的转化率为__。
(3)pK=-lgK,567K时,上述反应②的pK=___(结果保留两位有效数字,已知lg2=0.30)。
(4)567K下,若压缩容器体积为5L,则平衡时c(SO2)__(填“大于” “小于”或“等于”)上述反应平衡时的c(SO2)。
II.氯化亚砜常用于合成正丁酰氯。向连有尾气吸收装置的容器中按照物质的量1:1.5投料比加入正丁酸和氯化亚砜,反应为CH3CH2CH2COOH+SOCl2![]() CH3CH2CH2COCl+SO2↑+HCl↑。实验测得温度和时间对反应的影响如表:
CH3CH2CH2COCl+SO2↑+HCl↑。实验测得温度和时间对反应的影响如表:
序号 | 实验方法 | 收率/% |
1 | 25℃,反应6h | 73.60 |
2 | 25℃,反应8h | 74.60 |
3 | 75℃,反应2h | 75.00 |
4 | 75℃,反应3h | 76.00 |
5 | 先25℃,反应1h;后75℃,反应0~1h | 81.10 |
6 | 先25℃,反应1h;后75℃,反应0~1h | 87.10 |
(5)若开始在较高温度下反应,则会放出大量气体。通过分析上表数据,选择合理实验方法的序号为___。说明你选用实验方法的理由:____。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一块金属钠露置于空气中,观察到下列现象:
![]()
请回答下列问题:
(1)白色粉末的化学式是__________,过程②的化学方程式是_________。
(2)下列说法正确的是________。
A. 过程③为物理变化
B. 过程④是碳酸钠吸收空气中的CO2、水蒸气形成了碳酸氢钠
C. 过程⑤发生了分解反应
D. 整个变化过程中只有一个氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C均为中学化学常见的纯净物,它们之间存在如下转化关系,其中①②③均为有单质参与的反应。
![]()
(1)若A是常见的金属,①③中均有同一种气态非金属单质参与反应,B溶液遇KSCN显血红色,且②为化合反应,写出反应②的离子方程式________。
(2)若B是太阳能电池用的光伏材料,①②③为工业制备B的反应。C的化学式是______,写出反应①的化学方程式___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要配制250ml 1.6mol·L-1的NaOH溶液,请回答下列问题:
(1)称取NaOH固体______g。
(2)在配制该溶液的过程中,需经过称量、溶解、转移溶液、定容等操作,下列图示对应的操作规范是____。根据图示,除称量外还缺少的操作步骤依次是________、__________。

(3)在配制过程中,如果其他操作都正确,下列操作会引起NaOH溶液浓度偏低的是_______。
A. 称量好的固体放置一段时间后进行溶解操作
B. 溶液未冷却至室温即转移到容量瓶中
C. 容量瓶水洗后未干燥
D. 转移溶液时不慎有少量溶液滴出瓶外
E. 定容时不小心有蒸馏水滴出瓶外
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠(NaNO2)俗称“工业盐”,其外观与食盐相似,有咸味,有毒,可用做食品防腐剂和肉类食品的发色剂。已知亚硝酸钠能与氢碘酸(HI,具有强酸性)发生如下反应:4HI+2NaNO2=2NaI+I2+2NO↑+2H2O。下列说法正确的是
A. 亚硝酸钠具有氧化性,不可能表现出还原性
B. 该反应中氧化剂与还原剂的物质的量之比为1:1
C. 向反应所得的混合溶液中加入稀硫酸和亚硝酸钠,I-不可能转化为I2
D. 人误食亚硝酸钠中毒时,可服用氢碘酸解毒
查看答案和解析>>
科目: 来源: 题型:
【题目】磷及含磷化合物是重要的化工原料,广泛应用于洗涤剂、农药、医药、水处理等行业回答下列问题:
(1)基态P原子的轨道表示式为 ___(填字母)。
a.[Ne]![]() b.[Ne]
b.[Ne]![]()
c.[Ne]![]() d.[Ne]
d.[Ne]![]()
(2)黑磷是磷的一种同素异形体,与石墨烯类似,其晶体结构片段如图所示:
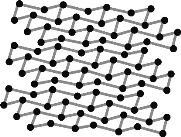
其中最小的环为___元环,每个环平均含有___个P原子。
(3)杀虫剂敌敌畏是有机磷化合物,其结构简式如图所示,其中C原子的杂化方式为____,甲基得一个电子后为CH3-,其空间构型为_____。
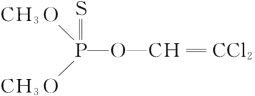
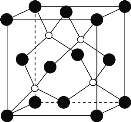
(4)磷化硼(BP)是一种超硬耐磨涂层材料,晶体中磷原子作面心立方最密堆积,硼原子填入四面体空隙中。
①PH3、NH3、BP三种物质的熔沸点由大到小的顺序为_____。
②磷化硼晶胞结构如图所示,晶胞参数a=b=c=478pm,α=β=γ=90°,则磷化硼的密度是___g·cm-3。(列出计算表达式,设阿伏加德罗常数为NA)
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,Ksp[Pd(OH)2]=1.0×10-30。向物质的量浓度相同的NaOH和Na2S的混合溶液中滴加Pd(NO3)2溶液产生Pd(OH)2、PdS两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。图中的p(Pd)=-lgc(Pd2+),p(B)=-lgc(OH-)或-lgc(S2-)。下列说法错误的是( )

A. 曲线Ⅰ表示的是Pd2+与OH-浓度关系的曲线
B. 该温度下,Ksp(PdS)=1.0×10 -58
C. 升高温度时,b点可能会向c点移动
D. 该温度下,向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
查看答案和解析>>
科目: 来源: 题型:
【题目】1.92gFe和Fe2O3的混合物溶于200mL盐酸中,生成0.336L(标准状况下)氢气,向反应后的溶液中加入KSCN检验,溶液不显红色。为让溶液中的金属离子恰好完全沉淀,消耗了400mL0.750 mol/L的氢氧化钠溶液。则:
(1)产生的氢气中所含的分子数为___。
(2)混合物中Fe和Fe2O3的物质的量之比为___。
(3)盐酸的物质的量浓度为___mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是

A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
查看答案和解析>>
科目: 来源: 题型:
【题目】将1molM和2 molN置于体积为2L的恒容密闭容器中,发生反应:M(s)+2N(g)![]() P(g)+Q(g) △H。反应过程中测得P的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )
P(g)+Q(g) △H。反应过程中测得P的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )

A. 若X、Y两点的平衡常数分别为K1、K2,则K1>K2
B. 温度为T1时,N的平衡转化率为80%,平衡常数K=40
C. 无论温度为T1还是T2,当容器中气体密度和压强不变时,反应达平衡状态
D. 降低温度、增大压强、及时分离出产物均有利于提高反应物的平衡转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com