
科目: 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%,质量分数),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO47H2O的工艺流程如下:
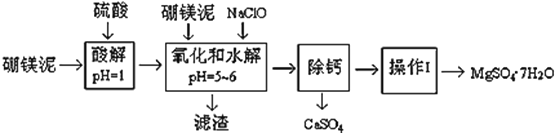
(1)实验中需要1 mol/L的硫酸800 mL,若用 98% 的浓硫酸(ρ= 1.84 g/mL)来配制,量取浓硫酸需要使用量筒的规格为__________(填写选项字母)
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可与Mn2+ 反应:Mn2+ + ClO + H2O = MnO2↓+ 2H+ + Cl ,在该步骤中还有一种离子也会被NaClO氧化,该反应的离子方程式为___________________。
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有__________,___________。
(4)在“除钙”前,需检验滤液中Fe3+ 是否被除尽,简述检验方法___________________。(写出操作、现象和结论)
(5)已知MgSO4、CaSO4 的溶解度(单位为 g/100 g 水)如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤______。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,______,便得到了MgSO47H2O
(6)实验中提供的硼镁泥共100 g,得到 MgSO47H2O为172.2 g ,则MgSO47H2O 的产率为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种重要的工业盐,易溶于水,微溶于乙醇。某化学兴趣小组对亚硝酸钠进行多角度探究:
Ⅰ.亚硝酸钠的制备。

(1)装置B的作用是___________________________________________。
(2)D中澄清石灰水变浑浊,则C中制备NaNO2的离子方程式为______________。
Ⅱ.探究亚硝酸钠与硫酸反应的气体产物成分。
已知:①NO+NO2+2OH-=2NO+H2O
②气体液化的温度:NO2为21 ℃,NO为-152 ℃
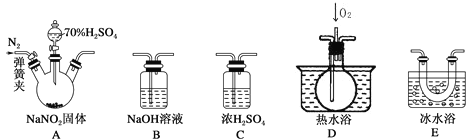
(3)反应前应打开弹簧夹,先通入一段时间氮气,目的是_______________________。
(4)仪器的连接顺序(按左→右连接):A→C→________。
(5)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,装置A中产生红棕色气体。
①确认装置A中产生的气体含有NO,依据的现象是_______________________。
②若D中通入过量O2,装置B中的化学方程式是_______________________。
Ⅲ.设计实验证明酸性条件下NaNO2具有氧化性。
(6)供选用的试剂:NaNO2溶液、KMnO4溶液、Fe2(SO4)3溶液、KI溶液、稀硫酸、淀粉溶液、KSCN溶液___________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设 NA 为阿伏加德罗常数,下列叙述正确的是( )
A.含1mol乙酸的溶液中H+数等于0.1NA
B.标准状况下,22.4L乙醇的分子数为NA
C.28g乙烯和丙烯所含碳氢键的数目为4NA
D.1 mol甲基所含的电子数为10NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某化合物由碳、氢、氧三种元素组成,其红外光谱图有C—H键、H—O键、C—O键的振动吸收,该有机物的相对分子质量是60,则该有机物的结构简式可能是
A. CH3CH2CH2OHB.  C. CH3CH2OCH3D. CH3CH2CHO
C. CH3CH2OCH3D. CH3CH2CHO
查看答案和解析>>
科目: 来源: 题型:
【题目】弱电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为 ___________________。
②下列方法中,可以使醋酸稀溶液中 CH3COOH 电离程度增大的是 __________________(填字母序号)。
a 滴加少量浓盐酸 b 微热溶液 c 加水稀释 d 加入少量醋酸钠晶体
(2)用 0.1 mol·L-1NaOH 溶液分别滴定体积均为 20.00 mL、浓度均为 0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液 pH随加入 NaOH溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是_______________(填“I”或“II”)。
②室温时,若 0.1 mol·L-1的醋酸的电离度为 1%,计算这醋酸溶液的 pH 值________。
③滴定开始前,三种溶液中由水电离出的 c(H+)最大的是________________。
④上述用 0.1 mol·L-1的 NaOH 溶液滴定 0.1 mol·L-1的盐酸,下列操作不正确的是________________。
A.用标准 NaOH 溶液润洗碱式滴定管后,再装入标准碱溶液
B.用待测酸溶液润洗锥形瓶后,再装入待测酸溶液
C.滴定时两眼应注视滴定管中液面的变化,以免滴定过量
D.读数时,视线应与滴定管凹液面的最低点保持水平
⑤上述滴定用酚酞作指示剂,滴定终点的现象_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】燃煤的烟气中含有 SO2,为了治理雾霾天气,工厂采用多种方法实现烟气脱硫。
Ⅰ.(1)“湿式吸收法”利用吸收剂与 SO2 发生反应从而脱硫。下列试剂中适合用作该法吸收剂的是_____(填字母序号)。
a. 石灰乳 b.CaCl2溶液
(2)某工厂利用含 SO2 的烟气处理含Cr2O72-的酸性废水,吸收塔中反应后的铬元素以Cr3+形式存在,具体流程如下:

①用 SO2 处理含铬废水时,利用了 SO2 的_____性。
②吸收塔中发生反应的离子方程式为_____。
Ⅱ.石灰-石膏法和烧碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为Ca(OH)2+SO2= CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O =2CaSO4·2H2O。其流程如图:

烧碱法的吸收反应为2NaOH+SO2=Na2SO3+H2O。该法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如图:

已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收 SO2 的成本(元/mol) | 0.027 | 0.232 |
(3)石灰-石膏法和烧碱法相比,石灰-石膏法的优点是_______,缺点是_______。
(4)某学习小组在石灰-石膏法和烧碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案,流程图中的甲、乙、丙各是_____、_____、_____(填化学式)

查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)③、④、⑤的原子半径由大到小的顺序为______(用元素符号回答)。
(2)②、③、⑦的最高价氧化物对应的水化物酸性由强到弱的顺序是_____。(用化学式回答)
(3)由①、④、⑤三种元素形成化合物的电子式______ 。
(4)⑥的单质与NaOH溶液反应的离子方程式_______。
(5)⑦的氢化物是一种无色气体,遇到空气能发生爆炸性自燃。已知室温下1 g氢化物自燃放出45.0 kJ的热量(产物水为液态),其热化学方程式为_________。
(6)由表中元素形成的常见物质A、B、C、D、E、F转化关系如下图所示。已知:A是常见的气态氢化物,B是能使带火星的木条复燃的无色无味气体, E的相对分子质量比D大17 ,D为红棕色气体(部分反应中生成物没有全部列出,反应条件未列出)

①A的结构式为_______。
②A和B反应生成C和F的化学方程式为_______,反应Ⅰ的离子方程式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业生产硝酸的尾气中含有氮氧化物NOx(假设仅为NO和NO2的混合物),影响生态环境。
Ⅰ.氮氧化物NOx 对环境主要影响有两点____、____。
Ⅱ.工业上可用氨催化吸收法处理NOx ,反应原理为:NH3 + NOx![]() N2 + H2O
N2 + H2O
某化学兴趣小组模拟该处理过程的实验装置如下:

(1)装置A中发生反应的化学方程式为________。
(2)装置C的作用有两个:一个作用是通过气泡产生的速率来控制反应物的比例,另一个作用是______。装置F的作用是_______。
(3)反应6 NO2+8 NH3![]() 7 N2+12 H2O可用于处理NO2。当转移3.6 mol电子时,消耗NO2的物质的量为_______mol。
7 N2+12 H2O可用于处理NO2。当转移3.6 mol电子时,消耗NO2的物质的量为_______mol。
Ⅲ.工业上也常用NaOH溶液吸收法处理NOx :
NO + NO2 + 2NaOH= 2NaNO2 + H2O (I)
2NO2 + 2NaOH =NaNO2 + NaNO3 + H2O (II)
(1)当NOx被NaOH溶液完全吸收时,转化为盐。x的值可能是_____(填字母)。
A.1.0 B.1.3 C.1.5 D.2.0
(2)2240 mL(标准状况)NO 和NO2的混合气体溶于200 mL NaOH溶液中,恰好完全反应,并无气体放出,则NaOH溶液物质的量浓度是__________。
Ⅳ.除能防止有毒气体的污染外,NaOH溶液吸收法还具有的优点是_____,其缺点是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:
步骤1:向废液中加入足量的NaCl溶液,将所得沉淀过滤,并洗涤干净。
步骤2:将沉淀放入烧杯,并放入铝片,再加入20%的Na2CO3溶液至浸没固体,加热搅拌,至沉淀变为灰白色[含有Ag、Al(OH)3和少量仍未反应的AgCl]。取出铝片,过滤并洗涤沉淀。
步骤3:……
(1)步骤1中检验所加NaCl溶液已经足量的方法是________________。
(2)步骤2加热时还产生能使澄清石灰水变浑浊的气体。写出该过程中发生反应的离子方程式:________________________________。
加入足量稀盐酸,充分反应后,过滤;洗涤沉淀,向沉淀中加入足量稀硝酸,充分反应后,过滤;将所得滤液蒸发浓缩、冷却结晶,过滤;用冰水洗涤、干燥,得到硝酸银晶体(实验中必须使用的试剂有:稀盐酸、稀硝酸、冰水)。
(3)已知:Ag++SCN-=AgSCN↓(白色)。实验室可通过如下过程测定所制硝酸银样品的纯度(杂质不参与反应):
①称取2.000g制备的硝酸银样品,加水溶解,定容到100mL。溶液配制过程中所用的玻璃仪器除烧杯、玻璃棒外还有_________。
②准确量取25.00mL溶液,酸化后滴入几滴铁铵钒[NH4Fe(SO4)2]溶液作指示剂,再用0.1000 mol·L-1NH4SCN标准溶液滴定。滴定终点的实验现象为________。
③重复②的操作两次,所用NH4SCN标准溶液的平均体积为29.00mL。则硝酸银的质量分数为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15. 2MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如图所示。
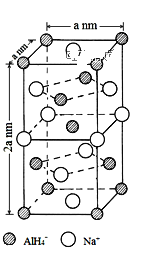
(1)基态Ti原子的价电子轨道排布图为___________。
(2)NaH的熔点为800℃,不溶于有机溶剂。NaH属于_____晶体,其电子式为____________。
(3)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为______________ (标明配位键)
(4)AlH4-中,Al的轨道杂化方式为_______;例举与AlH4-空间构型相同的两种离子_________(填化学式)。
(5)NaAlH4晶体中,与Na+紧邻且等距的AlH4-有______个;NaAlH4晶体的密度为______________g·cm-3(用含a的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com