
科目: 来源: 题型:
【题目】NA是阿伏伽德罗常数的值,下列相关说法正确的是( )
A.2.24LN2和O2的混合气体中分子数为0.1NA
B.2.4g镁在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA
C.标准状况下,22.4LCCl4中含有分子的数目为NA
D.0.1molFeCl3完全水解生成的Fe(OH)3胶体粒子数为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组微粒在指定溶液中一定能大量共存的是
A. ![]() =1012的溶液中:CH3CH2OH、MnO4-、K+、SO42-
=1012的溶液中:CH3CH2OH、MnO4-、K+、SO42-
B. 遇苯酚显紫色的溶液中:NH4+、K+、Cl-、SO42-
C. 由水电离产生的c(H+)=10-12mol/L的溶液中:K+、SO42-、C6H5OH、Cl-
D. 饱和氨水中:Ag+、Na+、NO3-、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学课外活动小组为了验证元素非金属性递变规律,设计了如图所示的两套实验方案进行实验探究:
(1)根据方案一装置![]() 如图
如图![]() 回答以下问题:
回答以下问题:
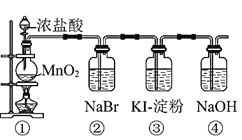
Ⅰ![]() 写出装置①中发生反应的化学方程式:______。
写出装置①中发生反应的化学方程式:______。
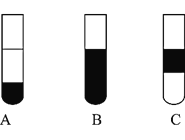
Ⅱ![]() 若将反应后②中的溶液倒入
若将反应后②中的溶液倒入![]() 中,出现的现象与图中吻合的是______。
中,出现的现象与图中吻合的是______。![]() 填代号
填代号![]()
Ⅲ![]() 装置③中的现象是______。
装置③中的现象是______。
(2)根据方案二装置![]() 如图
如图![]() 回答以下问题:
回答以下问题:

Ⅰ![]() 方案二验证元素非金属性递变的理论依据是:______。
方案二验证元素非金属性递变的理论依据是:______。
Ⅱ![]() 装置的作用是______,X是______。
装置的作用是______,X是______。
Ⅲ![]() 能说明碳元素与硅元素非金属性强弱的实验现象是______。
能说明碳元素与硅元素非金属性强弱的实验现象是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.在450℃并有催化剂存在下,在容积恒定的密闭容器内进行下列反应:2SO2 (g)+O2(g)![]() 2SO3(g) △H=-190kJmol-1
2SO3(g) △H=-190kJmol-1
(1)该反应500℃时的平衡常数____450℃时的平衡常数(填“>”、“<”或“=”)。
(2)450℃时,在2L密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是____。
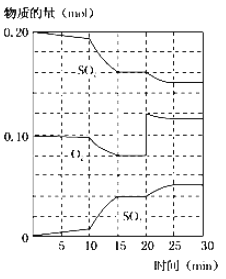
(3)据上图判断,反应进行至20min时,曲线发生变化的原因是___(用文字表达),10min到15min的曲线变化的原因可能是___(填字母)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3物质的量
(4)欲提高SO2的转化率,下列措施可行的是___。(填字母)
a.向装置中充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
II.已知HCl+O2![]() Cl2+H2O(未配平)中2mol HCl被氧化,放出57.8kJ的热量,且部分化学键断裂示意图如下:
Cl2+H2O(未配平)中2mol HCl被氧化,放出57.8kJ的热量,且部分化学键断裂示意图如下:
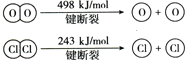
①写出该反应的热化学方程式是_____。
②断开1 mol H—O键与断开 1 mol H—Cl键所需能量相差约为___kJ,H2O中H—O键比HCl中H—Cl键_____(填“强”或“弱”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于下列化学用语,有关说法不正确的是
①SO2②Fe3+③KMnO4④![]() ⑤
⑤![]()
A.①表示的是两种元素组成的化合物
B.②中数字的含义:一个铁离子带3个单位的正电荷
C.③中锰元素的化合价为+7价
D.④⑤表示的是同一种元素
查看答案和解析>>
科目: 来源: 题型:
【题目】中国传统文化对人类文明贡献巨大,古代文献中记载了古代化学研究成果。下列常见古诗文对应的化学知识正确的是
常见古诗文记载 | 化学知识 | |
A | 《梦溪笔谈》中对宝剑的记载:“古人以剂钢为刃,柔铁为茎干,不尔则多断折” | 铁的合金硬度比纯铁的大,熔点比纯铁的高 |
B | 《本草纲目拾遗》中对强水的记载:“性最烈,能蚀五金,其水甚强,惟玻璃可盛” | 强水为氢氟酸 |
C | 《天工开物》中记载:凡火药,硫为纯阳,硝为纯阴 | 硫指的是硫黄.硝指的是硝酸钾 |
D | 《泉州府志》中记载:安南人黄姓者为宅煮糖,墙塌压糖,去土而糖白,后人遂效之 | 糖白的过程发生了化学变化 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】途经张家界的黔张常铁路是我国“八纵八横”高速铁路网之一,于2019年12月26日开通,高铁的铝合金车体的优势是:制造工艺简单,节省加工费用;减重效果好;有良好的运行品质;耐腐蚀,可降低维修费。工业上制备铝一般是从铝土矿(主要成分是Al2O3,含有Fe2O3杂质)中得到纯净的Al2O3,然后电解Al2O3得到铝。下图是从铝土矿中提纯Al2O3的简单示意图。其中涉及到的一个反应是:2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓。
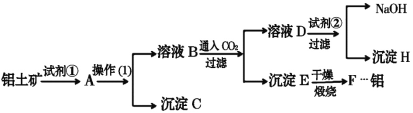
(1)图示中实验操作(1)是________;加入的试剂②是__________(填化学式)。
(2)试写出下列物质(或溶液中的溶质)的化学式:B__________________;D__________________;H________________。
(3)写出化学方程式:
①铝土矿→A:_____________________________________。
②E→F:_____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】随着环保意识增强,清洁能源越来越受到人们关注。
(1)甲烷是一种理想的洁净燃料。已知:CH4(g)+2O2(g)= CO2(g)+ 2H2O(g);△H= -802.3kJ·mol-1 H2O(1)=H2O(g),△H =+44.0kJ·mol-l
写出常温常压下甲烷完全燃烧的热化学方程式____,计算4.8g甲烷气体完全燃烧生成液态水,放出热量为____kJ。
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值。该反应为CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H=+206.lkJ·mol-l。
CO(g)+3H2(g)△H=+206.lkJ·mol-l。
①800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表。
CH4 | H2O | CO | H2 |
3.0 molL1 | 8.5 molL1 | 2.0 molL1 | 2.0 molL1 |
则此时正、逆反应速率的关系是正反应速率____逆反应速率。(填“>”、“<”、“=”)
②为了探究温度、压强对上述化学反应速率的影响,某同学设计了以下三组对比实验(温度为360℃或480℃、压强为101 kPa或303 kPa,其余实验条件见下表)。
实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/ molL1 | H2O初始浓度/ molL1 |
1 | 360 | p | 2.00 | 6.80 |
2 | t | 101 | 2.00 | 6.80 |
3 | 360 | 101 | 2.00 | 6.80 |
表中t=___,P=____;设计实验2、3的目的是____;实验l、2、3中反应的化学平衡常数的大小关系是____(用K1、K2、K3表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】钒钛磁铁矿炼钢后剩余的尾渣中含有V2O3、MgO、Al2O3、Fe2O3、SiO2等,现从该钒渣中回收V2O3及少量单质铝的工艺流程如下:
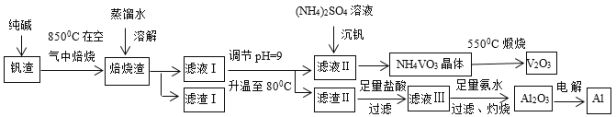
(1)滤液I的成分是NaVO3、NaAlO2和____(写化学式)。
(2)检验滤渣I中含有Fe2O3的方法是____。
(3)写出“焙烧”时生成NaVO3的化学方程式____。
(4)写出滤液Ⅲ与氨水反应生成沉淀的离子方程式____。
(5)NH4VO3和Na2SO4的混合液需要经过蒸发浓缩、趁热过滤、冷却结晶和过滤等操作得到NH4VO3晶体,结合图分析,为了得到较纯净的NH4VO3晶体和较高的晶体析出率,应选择最适宜的结晶温度为a、b、c、d四点中____点对应的温度。
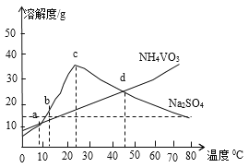
(6)若经过(5)步骤后得到的是粗NH4VO3晶体,则精制NH4VO3晶体需要采用的操作为____。
(7)滤渣I中有一种成分可作红色油漆,该物质的另外一种用途是____(任写一种)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点-54.1℃,沸点69.1℃。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g)![]() SO2Cl2(l)△H=-97.3kJ/mol
SO2Cl2(l)△H=-97.3kJ/mol
(1)若在此条件下,将化学平衡常数K减小,化学反应速率v正增大,可采取的措施是___(选填编号)。
a.升高温度 b.移走SO2Cl2 c.增加反应物浓度 d.无法满足上述条件
(2)为了提高上述反应中Cl2的平衡转化率,下列措施合理的是___(选填编号)。
a.缩小容器体积 b.使用催化剂 c.增加SO2浓度 d.升高温度
(3)在100℃时,往上述平衡体系中加入37Cl2,一段时间后,则平衡体系中含有37Cl的物质有___(选填编号)。
a.只有37Cl2 b.只有SO237Cl2 c.37Cl2和SO237Cl2 d.无法判断
(4)下列描述中能说明上述反应已达平衡状态的是____(选填编号)。
a.υ(Cl2)= υ(SO2) b.容器中气体压强不随时间而变化
c.c(Cl2) :c(SO2)=1 :1 d.容器中气体颜色不随时间而变化
(5)300℃时,体积为1L的密闭容器中充入16g SO2Cl2,达到平衡时容器中含SO2 7g。若在上述的平衡体系中,再加入16g SO2Cl2,当再次达平衡时,容器中含SO2的质量范围是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com