
科目: 来源: 题型:
【题目】25 ℃时,用pH试纸测得0.1 mol·L-1 NaNO2溶液的pH>7.
(1)NaNO2溶液pH>7的原因是(用离子方程式表示) ________,NaNO2溶液中c(HNO2)=________ (用溶液中其他离子的浓度关系式表示).
(2)常温下,将0.2 mol·L-1的HNO2和0.1 mol·L-1的NaOH溶液等体积混合,所得溶液的pH<7,说明HNO2的电离程度_______ (填“大于”或“小于”)NaNO2的水解程度.该混合溶液中离子浓度由大到小的顺序是______________.
(3)常温下,pH=3的HNO2溶液和pH=11的NaOH溶液等体积混合后溶液pH_________7,c(Na+) __________c(NO2-)(填“大于”或“小于”).
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关浓H2SO4的叙述中,正确的是( )
A.浓H2SO4与铜片共热的反应中,浓H2SO4既表现出强氧化性,又表现出酸性
B.浓H2SO4与金属活动性顺序中氢后面的金属反应生成的气体一般为H2
C.常温下,铁或铝不与浓H2SO4反应,所以可用铁或铝制的容器贮存浓H2SO4
D.浓H2SO4是不挥发性强酸,氢硫酸是挥发性弱酸,所以可用浓H2SO4与FeS反应制取H2S气体
查看答案和解析>>
科目: 来源: 题型:
【题目】福建有广阔的海岸线,建设海峡两岸经济区,海水的综合利用大有可为. 海水中溴含量约为65 mg·L-1,从海水中提取溴的工艺流程如图:

(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是______.
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的________。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
______Br2+______CO32-===______BrO3-+______Br-+______CO2↑
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏.写出溴与二氧化硫水溶液反应的化学方程式:_____.
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是________.
A.乙醇 B.四氯化碳 C.烧碱溶液 D.苯
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示为从固体混合物中分离X的两种方案,请根据方案1和方案2指出下列说法中合理的是( )

A. 可以选用方案1分离碳酸氢钠中含有的氯化铵
B. 方案1中的残留物应该具有的性质是受热易挥发
C. 方案2中加入的试剂一定能够与除X外的物质发生化学反应
D. 方案2中加入NaOH溶液可以分离出SiO2和Fe2O3混合物中的Fe2O3
查看答案和解析>>
科目: 来源: 题型:
【题目】在25℃、101kPa的条件下,断裂1molH—H键吸收436kJ能量,断裂1molCl—Cl键吸收243kJ能量,形成1molH-Cl键放出431 kJ能量。H2+Cl2=2HCl的化学反应可用如图表示:
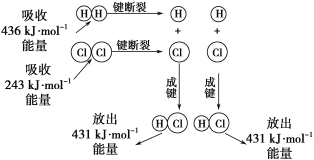
请回答下列有关问题:
(1)反应物断键吸收的总能量为___________________。
(2)生成物成键放出的总能量为______________。
(3)判断H2+Cl2=2HCl反应_____________(填“吸收”或“放出”)能量。
(4)反应物的总能量________(填“>”、“=”或“<”)生成物的总能量。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有Al、Cl2、Al2O3、HCl(aq)、A1(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断中不合理的是( )
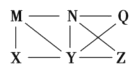
A. N一定是HCl(aq)B. X可能是Al或Cl2
C. Q、Z中的一种必定为A12O3D. Y一定为NaOH(aq)
查看答案和解析>>
科目: 来源: 题型:
【题目】将燃煤排放的含有SO2的烟气通入海水(主要含Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子)进行脱硫的工艺流程如图所示,下列说法中正确的是( )
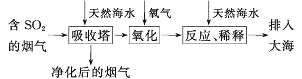
A. 天然海水显酸性
B. 氧化过程中可能发生的离子反应为2SO2+2H2O+O2=4H++2SO42-
C. 排入大海的溶液与天然海水相比,只有SO42-数量发生了变化
D. 若将氧化后的液体进行蒸发结晶,得到的晶体中CaSO4含量最高
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu:相对原子质量为64)。
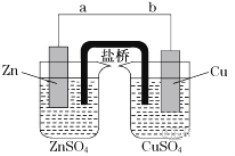
按照实验步骤依次回答下列问题:
(1)导线中电子移动方向为___(用a、b表示)。
(2)原电池的正极为__。
(3)写出装置中铜电极上的电极反应式:___。
(4)若装置中铜电极的质量增加32g,则导线中转移的电子数目为__。
(5)装置的盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,盐桥中的K+向__(填“左侧”或“右侧”)烧杯移动。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物在生活及工业生产中有着重要应用。请回答以下问题:
(1)如图是N2(g)、H2(g)与NH3(g)之间转化的能量关系图,则:
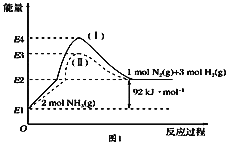
①N2(g)与H2(g)反应生成NH3(g)的热化学方程式为___________________.
②过程(Ⅰ)和过程(Ⅱ)的反应热________(填“相同”或“不同”).
③某温度下,在1 L恒温恒容容器中充入1molN2和3 mol H2进行上述反应,10 min达到平衡,此时容器内压强变为原来的7/8.
a.该过程的平衡常数的表达式为____________.
b.N2的平衡转化率为________.
c.此时若保持容器温度和体积不变,向其中再加入2.25 molN2和0.5 mol NH3,则平衡________(填“正向”“逆向”或“不”)移动.
(2)用NH3可以消除氮氧化物的污染,已知:
反应Ⅰ:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
反应Ⅱ:N2(g)+O2(g)![]() 2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
反应Ⅲ:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
则反应Ⅱ中的b=_____(用含a、c的代数式表示),K3=_____(用K1和K2表示).反应Ⅲ中的ΔS______(填“>”“<”或“=”)0.
(3)在恒容的密闭器中,充入一定量的NH3和NO进行上述反应Ⅲ,测得不同温度下反应体系中NH3的转化率(α)与压强p的关系如图所示:
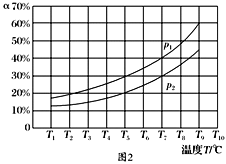
①分析得p1________p2.(填“>”“<”或“=”)
②下列叙述中,不能作为判断反应Ⅲ已经达到平衡状态的标志的是________(填序号).
a.N2的浓度不再改变 b.断裂6 mol N—H键的同时,有6 mol H—O键形成
c.容器中压强不再变化 d.混合气体的密度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com