
科目: 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。请根据下表中短周期元素的原子半径和主要化合价,回答表后问题。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10 m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 1.11 | 0.75 | 1.43 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
-2 | -3 | -1 | -3 |
(1)元素①在周期表中的位置为_____。
(2)元素①、⑦的氢化物的稳定性由强到弱的顺序为____(填化学式)。
(3)元素①、③形成的18电子化合物的电子式为____,元素②、⑧的最高价氧化物对应的水化物中,碱性较强的是______(填化学式)。
(4)元素②、⑤形成化合物的电子式为_____。
(5)元素⑤的最高价氧化物对应的水化物的水溶液与元素⑧的最高价氧化物对应水化物反应的离子方程式为
查看答案和解析>>
科目: 来源: 题型:
【题目】水杨酸冬青油、阿司匹林的结构简式如图,下列说法不正确的是

A. 由水杨酸制冬青油的反应是取代反应
B. 阿司匹林的分子式为C9H8O4,在一定条件下水解可得水杨酸
C. 冬青油苯环上的一氯取代物有4种
D. 可用NaOH溶液除去冬青油中少量的水杨酸
查看答案和解析>>
科目: 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.关于该电池的叙述正确的是( )

A. b极发生氧化反应
B. a极为该电池的正极
C. 放电时,电流从a极经过负载流向b极
D. a极的反应式:N2H4+4OH﹣﹣4e﹣═N2↑+4H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】意大利罗马大学的科学家获得了极具理论研究意义的N4分子,N4分子结构如图所示。下列有关N4的说法正确的是( )
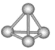
A. N4的沸点比N2低
B. N4分子中只含有非极性键,且键的夹角为109°28′
C. N4分子中每个氮原子都满足8个电子
D. 1mol N4中含有9 mol共价键
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列叙述正确的是
A.1mol ICl与H2O完全反应生成氯化氢和次碘酸,转移的电子数为NA
B.常温常压下,56 g丁烯 (C4H8)中含有的共价单键总数为8 NA
C.电解精炼铜时,阳极质量减少64g,闭合回路转移的电子数一定为2NA
D.质量均为3.2g的S2、S4、S6中所含S原子数相等,都为0.1 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】反应 4NH3+5O2![]() 4NO+6H2O(g)在 5L 的密闭容器中进行,半分钟后,NO 的物质的量增 加了 0.3mol,则下列反应速率正确的是 ( )
4NO+6H2O(g)在 5L 的密闭容器中进行,半分钟后,NO 的物质的量增 加了 0.3mol,则下列反应速率正确的是 ( )
A. v(O2)=0.01mol/(L·s) B. v(NO)=0.008 mol/(L·s)
C. v(H2O)=0.015 mol/(L·s) D. v(NH3)=0.002 mol/(L·s)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用废镍催化剂(主要成分为Ni,还含有一定量的Zn、Fe、SiO2、CaO)制备草酸镍晶体(NiC2O4·2H2O)的流程如下:
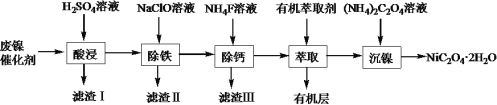
(1)NiC2O4·2H2O中C的化合价是______。既能加快“酸浸”反应速率又能提高“酸浸”原料利用率的操作措施为_____________。
(2)“滤渣Ⅰ”的主要成分是_____________。若控制温度为80℃、pH=2时,“除铁”产生的“滤渣Ⅱ”的主要成分为黄钠铁矾(Na2Fe6(SO4)4(OH)12),写出生成黄钠铁矾沉淀的离子方程式:__________________。
(3)已知“滤渣Ⅲ”的主要成分为CaF2,则“萃取”操作中加入有机萃取剂的作用是__________。
(4)在隔绝空气的条件下,高温煅烧无水NiC2O4得到Ni2O3和两种含碳元素的气体,该反应的化学方程式是_________。
(5)高能锂离子电池的总反应为2Li + FeS = Fe + Li2S。用该电池作电源电解含镍酸性废水回收Ni的装置如图(图中X、Y为电极,LiPF6·SO(CH3)2为电解质)。
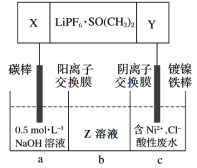
①电极X的反应材料是_________(填化学式);中间隔室b可以得到的主要物质Z是_________(填化学式)。
②电解总反应的离子方程式为_________。已知F=96500C/mol,若电池工作t min,维持电流强度为I A,理论回收Ni_________g(写出计算表达式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】毒奶粉事件曾一度震惊全国,主要是奶粉中含有有毒的三聚氰胺。下列关于三聚氰胺分子的说法中正确的是( )

A. 所有氮原子均采取sp3杂化
B. 一个三聚氰胺分子中共含有15个σ键
C. 三聚氰胺的分子式为C3N3H6
D. 三聚氰胺分子中同时含有极性键和非极性键
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,可逆反应:A2(g)+B2(g)![]() 2AB(g),达到平衡的标志是( )
2AB(g),达到平衡的标志是( )
A.容器的总压强不随时间而变化
B.单位时间内生成nmolA2同时就有2nmolAB生成
C.单位时间内有nmolB2发生反应的同时有nmolAB分解
D.单位时间内有nmolA2生成的同时有nmolB2生成
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式硫酸铝溶液可用于烟气脱硫。室温下向一定浓度的硫酸铝溶液中加入一定量的碳酸钙粉末,反应后经过滤得到碱式硫酸铝溶液,反应方程式为(2x)Al2(SO4)3+3xCaCO3+3xH2O=2[(1x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑。生成物(1x)Al2(SO4)3·xAl(OH)3中x值的大小影响碱式硫酸铝溶液的脱硫效率。
通过测定碱式硫酸铝溶液中相关离子的浓度确定x的值,测定方法如下:
①取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.3300 g。
②取碱式硫酸铝溶液2.50 mL,稀释至25 mL,加入0.1000 mol·L1EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.08000 mol·L1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com