
科目: 来源: 题型:
【题目】化合物A最早发现于酸牛奶中,它是人体糖代谢的中间体,可由玉米淀粉发酵制得,其盐是人们喜爱的补钙制剂之一。A在铜的催化作用下可发生氧化反应,其氧化产物不能发生银镜反应。在浓硫酸的作用下,A可发生如下反应
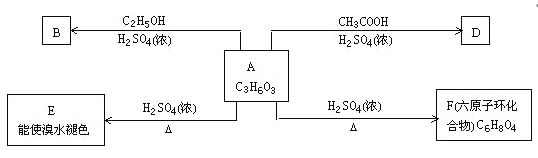
试回答下列问题:
(1)写出下列物质的结构简式:A________ F________
(2)A→B的反应类型________
(3)写出下列反应的化学方程式:
A→E______________________
A→D_____________________
查看答案和解析>>
科目: 来源: 题型:
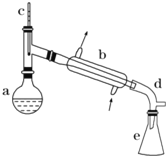
【题目】醇脱水是制取烯烃的常用方法,实验室以环己醇为原料制取环己烯的实验装置如图所示。
反应的化学方程式:
合成反应: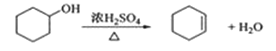
在a中加入40g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中,分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯20g。
可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
回答下列问题:
(1)装置b的名称是___________
(2)加入碎瓷片的作用是_________
(3)本实验中最容易产生的副反应的化学方程式为______________
(4)分离提纯过程中加入无水氯化钙的目的是________________
(5)本实验所得到的环己烯产率是____(填正确答案标号)
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目: 来源: 题型:
【题目】能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。
(1)氢气燃烧,该反应是___反应(填“吸热”或“放热”),这是由于反应物的总能量___(填“大于”“小于”或“等于”)生成物的总能量;从化学反应的本质来看,是由于断裂反应物中的化学键吸收的总能量___(填“大于”“小于”或“等于”)形成产物的化学键放出的总能量。
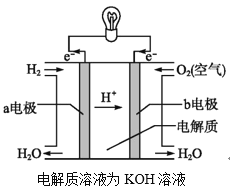
(2)通过氢气的燃烧反应,可以把氢气中储存的化学能转化为热能,如果将该氧化还原反应设计成原电池装置,就可以把氢气中储存的化学能转化为电能,如图就是能够实现该转化的装置,被称为氢氧燃料电池。
该电池的正极是___(填“a电极”或“b电极”),电极反应式为___,该电极上的物质发生反应的反应类型是___(填“氧化反应”或“还原反应”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】今有化合物
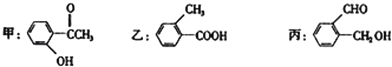
(1)请写出甲中含氧官能团的名称:________
(2)请判别上述哪些化合物互为同分异构体:_______
(3)甲、乙、丙三种物质中,遇FeCl3溶液显紫色的是_____(填“甲”“乙”或“丙”,下同),能与银氨溶液发生银镜反应的是_____,能与碳酸钠溶液反应放出CO2气体的是_____
(4)请按酸性由强至弱排列甲、乙、丙的顺序:_______
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为___,c(N2O5)为___,O2的物质的量浓度为___。
4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为___,c(N2O5)为___,O2的物质的量浓度为___。
(2)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。根据图中数据填空:

①该反应的化学方程式为___。
②反应至平衡时,v(X)为___,c(Z)为___。
③若X、Y、Z均为气体,则达平衡时,容器内混合气体的平均相对分子质量比起始投料时___(填“增大”“减小”或“相等”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将甲烷与氯气按1:3的体积比混合于一试管中,倒立于盛有饱和食盐水的水槽,置于光亮处(如图所示),下列有关此实验的现象和结论的叙述不正确的是( )
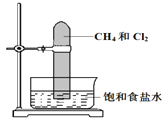
A. 试管中气体的黄绿色逐渐变浅,水面上升
B. 生成物只有三氯甲烷和氯化氢在标准状况下是气体
C. 试管内壁有油状液滴形成
D. 试管内有少量白雾
查看答案和解析>>
科目: 来源: 题型:
【题目】“张亭栋研究小组”受民间中医启发,发现As2O3对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)为第VA族元素,该族元素的化合物在研究和生产中有着许多重要用途。
(1)N原子的价电子排布式为___,N、P、As原子的第一电离能由大到小的顺序为___。
(2)NH3的沸点比AsH3的沸点高,原因是_____。
(3)立方氮化硼晶体(BN),是一种超硬材料,有优异的耐磨性,其晶胞如图所示。
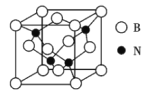
立方氮化硼是____晶体,晶体中N原子的杂化轨道类型为___,B原子的配位数为______。
(4)若立方氮化硼晶胞的边长为362 pm,则立方氮化硼的密度为____g/cm3(只要求列算式,不必计算出数值,阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)据科技日报网报道,南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现烯丙醇高效、绿色合成。烯丙醇及其化合物可制成甘油、医药、农药、香料,合成维生素E和KI及天然抗癌药物紫杉醇中都含有关键的烯丙醇结构。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
①基态镍原子的价电子排布式为________。
②1 mol CH2=CH-CH2OH含___molσ键,烯丙醇分子中碳原子的杂化类型为___。
③Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(CN)2]2- 和[Ni(SCN)2]- 等,与CN-互为等电子体的分子为_____。
(2)乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
①CaC2中C22-中碳与碳之间存在碳碳三键,C22-与O22+互为等电子体,O22+的电子式可表示为_______。
②乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z为原子序数依次增大的短周期主族元素,其中Y元素在同周期中离子半径最小;甲、乙分别是元素Y、Z的单质;丙、 丁、戊是由W、X、Y、Z元素组成的二元化合物,常温下丁为液态;戊为酸性气体,常温下0.01mol·L-1戊溶液的pH大于2。上述物质转化关系如图所示。下列说法正确的是
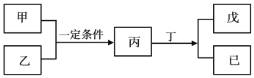
A.原子半径:Z>Y>X>W
B.W和X形成的化合物既可能含有极性键也可能含有非极性键
C.Z的氧化物对应的水化物均为强酸
D.简单氢化物的热稳定性:X<Z
查看答案和解析>>
科目: 来源: 题型:
【题目】利用图示装置进行实验,反应进行足够长时间后装置II中实验现象正确的是
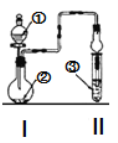
① | ② | ③ | II中实验现象 | |
A | 浓盐酸 | 大理石 | 氯化钡溶液 | 产生大量白色沉淀 |
B | 浓氨水 | 碱石灰 | 硫酸亚铁溶液 | 产生大量白色沉淀 |
C | 冰醋酸 | 乙醇和浓硫酸 | 饱和碳酸钠溶液 | 溶液分层,上层为油状液体 |
D | 浓盐酸 | KMnO4 | 氢硫酸 | 产生淡黄色沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com