
科目: 来源: 题型:
【题目】高炉炼铁过程中发生的主要反应为:![]() Fe2O3(s) + CO(g)
Fe2O3(s) + CO(g) ![]()
![]() Fe(s) + CO2(g)。已知该反应在不同温度下的平衡常数如下:
Fe(s) + CO2(g)。已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K=_____________,△H________0(填“>”、“<”或“=”)。
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe2O3、CO各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率υ(CO2)=______________________、CO的平衡转化率= _____________。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂
(4)在1L的密闭容器中,1300℃条件,下列达平衡状态的是_______________。
A | B | C | D | |
n(Fe2O3) | 0.350 | 0.027 | 0.080 | 0.080 |
n(CO) | 0.010 | 0.010 | 0.010 | 0.050 |
n(Fe) | 0.100 | 0.064 | 0.080 | 0.080 |
n(CO2) | 0.035 | 0.088 | 0.040 | 0.050 |
.
查看答案和解析>>
科目: 来源: 题型:
【题目】运用盖斯定律可计算一些不易测定的反应的反应热。
(1)已知在298K时下述反应的有关数据:C(s) +![]() O2(g)=CO(g) △H1=-110.5 kJ·mol-1,C(s) + O2(g)=CO2(g) △H2=-393.5 kJ·mol-1。则C(s) + CO2(g)=2CO(g) 的△H为__________________。
O2(g)=CO(g) △H1=-110.5 kJ·mol-1,C(s) + O2(g)=CO2(g) △H2=-393.5 kJ·mol-1。则C(s) + CO2(g)=2CO(g) 的△H为__________________。
(2)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。
已知:N2(g) + 2O2(g)=2NO2(g) △H=+67.7 kJ·mol-l;
N2H4(g) + O2(g)=N2(g) + 2H2O(g) △H=-534 kJ·mol-l。
则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe2+的价电子排布式为_______。
(2)氮气、氨气、肼(N2H4)中氮原子孤电子对数之比为_______,氨分子的空间构型是______
(3)丙酮(![]() )分子中碳原子轨道的杂化类型是_____,1 mol 丙酮分子中含有σ键的数目为______。
)分子中碳原子轨道的杂化类型是_____,1 mol 丙酮分子中含有σ键的数目为______。
(4)C、N、O三种元素的电负性由小到大的顺序为______。
(5)乙醇的沸点高于丙酮,这是因为_____。
(6)CN-与N2是等电子体,CN-的电子式为______。
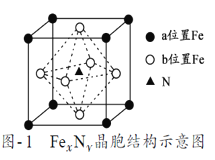
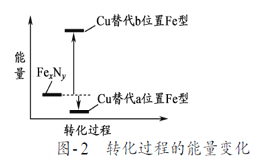
(7)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(xn)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为___,若晶胞参数为a pm,则该晶胞的密度为____g/cm3。
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;
FeO(s)+CO(g)的平衡常数为K1;
反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。
FeO(s)+H2(g)的平衡常数为K2。
在不同温度时K1、K2的值如下表:
温度(绝对温度) | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
(1)推导反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:_____________________。
CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:_____________________。
(2)通过K值的计算,(1)中的反应是_________反应(填“吸热”或“放热”)。
(3)在一体积为10L的密闭容器中,加入一定量的CO2和H2O(g),在1173开时发生反应并记录前5min的浓度,第6min时改变了反应的条件。各物质的浓度变化如下表:
时间/min | CO2 | H2O | CO | H2 |
0 | 0.2000 | 0.3000 | 0 | 0 |
2 | 0.1740 | 0.2740 | 0.0260 | 0.0260 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | |
5 | 0.0727 | 0.1727 | 0.1273 | 0.1273 |
6 | 0.0350 | 0.1350 | 0.1650 |
①前2min,用CO表示的该化学反应的速率是:_______________________。
②在3~4min之间,反应处于___________状态(填“平衡”或“非平衡”)。
③第6min时,平衡向_________方向移动,可能的原因是______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.在一密闭容器中充入1molH2和1molI2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)![]() 2HI(g)。
2HI(g)。
(1)保持容器容积不变,向其中充入1molHe,反应速率________(填“加快”“减慢”或“不变”,下同)。
(2)保持容器内气体压强不变,向其中充入1molHe,反应速率________。
II.航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置。它可直接将化学能转化为电能,氢氧燃料电池以KOH溶液为电解质,其总反应的化学方程式为2H2+O2=2H2O。
(3)负极上的电极反应为______________________________。
(4)工作过程中时,溶液的c(OH-)_______(填“增大”、“减小”或“不变”)。
Ⅲ..A、B、C、D、E、W、T六种短周期主族元素,它们的核电荷数依次增大。A可与D、E形成10电子分子。B原子的最外层电子数等于次外层电子数,C原子最外层电子数是次外层电子数的2倍,W的L层电子数为K层和M层电子数之和,D和W同主族。回答下列问题:
(5)元素B在周期表中的位置是_______________________。
(6)元素C的原子结构示意图为_______________________。
(7)元素C与W可形成CW2,C与T可形成CT4,这两种化合物均可做溶剂,其电子式分别为____________________________________。
(8)元素A与D、E形成10电子分子的结构式分别为_______________________________。
(9)元素D、W的简单氢化物的沸点高的为____________(用化学式表示)。
(10)1molCA4与D2完全反应生成两种气体时放出热量802kJ,则该反应的热化学方程式为__________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)Co(NH3)5BrSO4可形成两种钴的配合物,已知两种配合物的分子式分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br,分别向两种配合物的溶液中加BaCl2溶液,有白色沉淀产生的是_____。
(2)向CuSO4溶液中逐滴加入稀氨水,所得配合物的化学式为_____,该配合物中存在的化学键类型为_________。
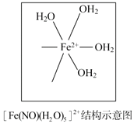
(3)铁可形成多种配位化合物,但与氨形成的化合物不稳定,如FeCl2虽然可以与氨气形[Fe(NH3)6]Cl2,但此物质遇水即生成灰白色沉淀,写出对应的反应方程式:_____。[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关热化学方程式书写与对应表述均正确的是
A. 稀硫酸与0.1 mol·L-1 NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l) ΔH=+57.3 kJ·mol-1
B. 在101 kPa下H2(g)的燃烧热为285.8 kJ·mol-1,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g) ΔH=+285.8 kJ·mol-1
C. 已知CH3OH的燃烧热为726.8 kJ·mol-1,则有CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(g) ΔH=-726.8 kJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH=-726.8 kJ·mol-1
D. 已知9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g FeS时放出19.12 kJ热量,则Fe(s)+S(s)=FeS(s) ΔH=-95.6 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,在1L的密闭容器中充入NO2发生如下反应:2NO2(g)![]() N2O4(g)△H=-57 kJ·mol-1(N2O4在25℃时为无色气体)。
N2O4(g)△H=-57 kJ·mol-1(N2O4在25℃时为无色气体)。
(1)该反应的ΔS__________0(填“>”、“<”或“=”)。
(2)当开始充入0.03mol的NO2时,25℃时,实验测得NO2的平衡浓度为0.01 mol·L-1,则NO2的平衡转化率(α)是_____________。25℃时上述反应的平衡常数K =_________。
(3)25℃时,实验测得该反应的活化能Ea=92.4 kJ·mol-1。下列能量关系图合理的是_____。
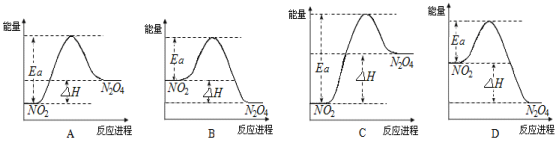
(4)如把该密闭容器放入80℃的热水中,则气体的颜色___________(填“不变”、“加深”或“变浅”),NO2的转化率___________(填“增大”、“不变”或“减小”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是某原电池的装置图。其电池的总反应是:2Ag+(aq) + Cu(s) = Cu2+(aq) + 2Ag(s)。请回答以下问题:
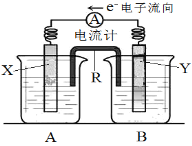
(1)R的名称是__________,R中的阳离子移向________(填“A”或“B”)中的溶液。
(2)电极Y的材料是______________,B中的电解质溶液是________________。
(3)X为原电池的______(填“正”或“负”)极,其电极反应式是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com