
【题目】高炉炼铁过程中发生的主要反应为:![]() Fe2O3(s) + CO(g)
Fe2O3(s) + CO(g) ![]()
![]() Fe(s) + CO2(g)。已知该反应在不同温度下的平衡常数如下:
Fe(s) + CO2(g)。已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K=_____________,△H________0(填“>”、“<”或“=”)。
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe2O3、CO各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率υ(CO2)=______________________、CO的平衡转化率= _____________。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂
(4)在1L的密闭容器中,1300℃条件,下列达平衡状态的是_______________。
A | B | C | D | |
n(Fe2O3) | 0.350 | 0.027 | 0.080 | 0.080 |
n(CO) | 0.010 | 0.010 | 0.010 | 0.050 |
n(Fe) | 0.100 | 0.064 | 0.080 | 0.080 |
n(CO2) | 0.035 | 0.088 | 0.040 | 0.050 |
.
【答案】K= ![]() < 0.008 mol·L-1·min-1 80% C A
< 0.008 mol·L-1·min-1 80% C A
【解析】
(1)根据化学平衡常数的定义可知:K=![]() ;
;
由于温度升高,化学平衡常数减小,说明升高温度,平衡向逆反应方向移动,逆反应是吸热反应,该反应的正反应为放热反应 ,△H<0;
(2)![]() Fe2O3(s) + CO(g)
Fe2O3(s) + CO(g) ![]()
![]() Fe(s) + CO2(g)
Fe(s) + CO2(g)
起: 1 mol 1 mol 1 mol 1 mol
变: ![]() x x
x x ![]() x x
x x
终: 1 mol- ![]() x 1 mol- x 1 mol+
x 1 mol- x 1 mol+ ![]() x 1 mol+ x
x 1 mol+ x
平衡常数只与温度有关,且已知1000℃时 K=4.0
即:K=![]() =
=![]() =4.0,解得:x = 0.8 mol 则υ(CO2)=
=4.0,解得:x = 0.8 mol 则υ(CO2)=  = 0.008 mol/ (L·min);
= 0.008 mol/ (L·min);
CO的平衡转化率=![]() = 80%;
= 80%;
(3)A、因Fe为固体,对平衡没有影响,选项A错误;
B、因Fe2O3为固体,对平衡没有影响,选项B错误;
C、CO2为气体生成物,减少生成物浓度平衡向正反应方向移动,选项C正确;
D、升高温度平衡向吸热反应方向移动。对于该反应来说是向逆反应方向移动,CO的平衡转化率降低,选项D错误;
E、因为该反应是前后气体相等的可逆反应。所以减小容器的容积也就是增大压强。化学平衡不发生移动。CO的平衡转化率不变。选项E错误;
F、催化剂只改变化学反应速率而不影响平衡的移动,选项F错误。
答案选C;
(4)A、浓度商Qc=![]() =3.5,等于平衡常数,故处于平衡状态,选项A符合;
=3.5,等于平衡常数,故处于平衡状态,选项A符合;
B、浓度商Qc=![]() =8.8,大于平衡常数3.5,故反应向逆反应进行,选项B不符合;
=8.8,大于平衡常数3.5,故反应向逆反应进行,选项B不符合;
C、浓度商Qc=![]() =4,大于平衡常数3.5,故反应向逆反应进行,选项C不符合;
=4,大于平衡常数3.5,故反应向逆反应进行,选项C不符合;
D、浓度商Qc=![]() =1,小于平衡常数3.5,故反应向正反应进行,选项D不符合;
=1,小于平衡常数3.5,故反应向正反应进行,选项D不符合;
答案选A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】NOx(主要指NO和NO2)是大气主要污染物之一,有效去除大气中的NOx是环境保护的重要课题。可以利用NH3与NOx反应消除NOx。

(1)实验室制取NH3,发生装置可以选择上图中的____________,反应的化学方程式为____________。
(2)欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→____________(按气流方向,用小写字母表示)。
(3)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。NH3与NO2生成N2的反应中,当生成1molN2时,转移电子的物质的量为____________mol。
(4)用酸性(NH2)2CO水溶液也可以吸收NOx,吸收过程中存在HNO2与CO(NH2)2生成N2和CO2的反应。该反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白黎芦醇具有抗氧化和预防心血管疾病的作用。可通过以下方法合成:
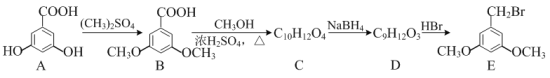

⑴化合物A中所含官能团的名称为______和______。
⑵由F→G的反应类型是______。
⑶D的结构简式为______。
⑷写出同时满足下列条件的C的一种同分异构体的结构简式:______。
①能发生银镜反应,与FeCl3溶液不显色;
②能发生水解反应,水解产物之一能与FeCl3溶液显色;
③分子中含有4种不同化学环境的氢。
⑸请写出以苯甲酸、甲醇为原料制备![]() 的合成路线流程图,无机试剂可任选,合成示例见本题题干。_________________
的合成路线流程图,无机试剂可任选,合成示例见本题题干。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol某气态链烃充分燃烧可以生成7.2克水。请据此回答以下问题:
(1)通过计算确定该烃的分子式可能为_____、______(可不填满)。
(2)若经测定该烃存在支链,则该烃的结构简式为________,其同分异构体有多种,写出属同类烃的所有同分异构体的结构简式并命名(可不填满):
结构简式:________名称:________;
结构简式:________名称:________;
结构简式:________名称:________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Co(NH3)5BrSO4可形成两种钴的配合物,已知两种配合物的分子式分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br,分别向两种配合物的溶液中加BaCl2溶液,有白色沉淀产生的是_____。
(2)向CuSO4溶液中逐滴加入稀氨水,所得配合物的化学式为_____,该配合物中存在的化学键类型为_________。
(3)铁可形成多种配位化合物,但与氨形成的化合物不稳定,如FeCl2虽然可以与氨气形[Fe(NH3)6]Cl2,但此物质遇水即生成灰白色沉淀,写出对应的反应方程式:_____。[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体_____。
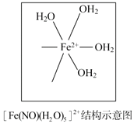
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
① C2H2(g) +![]() O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJmol-1
O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJmol-1
② C(s)+ O2(g) = CO2(g) △H2=-393.5 kJmol-1
③ H2(g)+![]() O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1
O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1
则反应④ 2C(s)+ H2(g) = C2H2(g)的△H为( )
A.+228.2 kJ·mol-1B.-228.2 kJ·mol-1
C.+1301.0 kJ·mol-1D.+621.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A的电子式为![]() ,B原子L层的电子总数是K层的3倍;0.1 mol C单质从酸中置换出2.24 L氢气(标准状况),同时它变成Ne原子的电子层结构;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
,B原子L层的电子总数是K层的3倍;0.1 mol C单质从酸中置换出2.24 L氢气(标准状况),同时它变成Ne原子的电子层结构;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
(1)写出A、B、C、D元素的名称:A______、B______、C______、D______;
(2)D元素在周期表中第______周期第______族;
(3)用电子式表示A的气态氢化物的形成过程_______________________;
(4)A和B的单质充分反应生成的化合物的结构式是__________________;
(5)四种元素中,______的最高价氧化物的水化物既能溶于酸,又能溶于碱,溶于NaOH溶液的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应:A(s)+3B(g) ![]() 2C(g)+D(g) 已达平衡状态的是
2C(g)+D(g) 已达平衡状态的是
A.混合气体的压强B.混合气体的密度
C.B和C的物质的量浓度相等D.气体的总物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化为放热反应的是( )
A.H2O(g)=H2O(l) △H=-44.0 kJ/mol
B.2HI(g)=H2(g)+I2(g) △H=+14.9 kJ/mol
C.形成化学键时共放出能量862 kJ的化学反应
D.能量变化如图所示的化学反应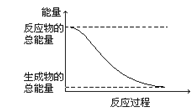
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com