
科目: 来源: 题型:
【题目】水合肼(N2H4·H2O)又名水合联氨,是无色透明、具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂,利用尿素法生产水合肼的原理为CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl。
实验一:制备NaClO溶液。(实验装置如图1所示)

(1)下列仪器在配制100 mL7.5mol/L的NaOH溶液时,可能用到的有_______(填字母)。
A.容量瓶 B.烧瓶 C.胶头滴管 D.玻璃棒
(2)锥形瓶中发生反应的离子方程式为____。
实验二:制取水合肼。(实验装置如图2所示)
(3)①装置A的名称为____,反应过程中需控制反应温度,同时将分液漏斗中溶液缓慢滴入A中,如果滴速过快则会导致产品产率降低,同时产生大量氮气,写出该过程的化学反应方程式:____________,故分液漏斗中的溶液是_____(填字母)。
A. CO(NH2)2溶液 B. NaOH和NaClO
②充分反应后,加热A内的溶液,收集108~114℃的馏分,即可得到水合肼的粗产品。
实验三:测定馏分中肼含量。
(4)称取馏分5.0 g,加入适量NaHCO3固体,加水配成250 mL溶液,移岀25.00 mL置于锥形瓶中,并滴加23滴淀粉溶液,用0.10 mol/L的标准I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4·H2O + 2I2=N2↑+ H2O+4HI)
滴定时,碘的标准溶液盛放在____(填“酸式”或“碱式”)滴定管中;本实验滴定终点的现象为____。实验测得消耗I2溶液的平均值为18.00 mL,馏分中水合肼(N2H4·H2O)的质量分数为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列变化为放热反应的是( )
A.H2O(g)=H2O(l) △H=-44.0 kJ/mol
B.2HI(g)=H2(g)+I2(g) △H=+14.9 kJ/mol
C.形成化学键时共放出能量862 kJ的化学反应
D.能量变化如图所示的化学反应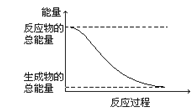
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,X、Y、Z、W为短周期主族元素,W的原子序数是Z的2倍。下列说法中正确的是
X | Y | Z | ||
W |
A.简单离子半径:Y<Z
B.Y元素的最高价氧化物对应的水化物在一定条件下可以和X单质反应
C.氢化物的沸点:X<Z
D.WZ2具有漂白性,其漂白原理与双氧水相同
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料,一种以含镍废料(含 NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:

相关离子生成氢氧化物的pH和相关物质的溶解性如表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时溶解性(H2O) | |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 | |
Fe2+ | 5.8 | 8.8 | NiF | 可溶 | |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 | |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.6×10﹣6 |
(1)调节pH步骤中,溶液pH的调节范围是___________。
(2)滤渣1主要成分是_______________;滤渣2主要成分是_________________
(3)写出氧化步骤中加入H2O2发生反应的离子方程式_________。
(4)酸浸过程中,1mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式____________。
(5)沉镍过程中,若c(Ni2+)=2.0mol/L,欲使100mL该滤液中的Ni2+沉淀物完全,[c(Ni2+)≤10﹣5 mol/L],则需要加入Na2CO3固体的质量最少为_____g(保留小数点后1位)
(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸。酸浸出率随时间变化如图。酸浸的最佳温度与时间分别为____________。

查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用绿矾(FeSO4·7H2O)为原料制备补血剂甘氨酸亚铁[(H2NCH2COO)2Fe],有关物质性质如下:
甘氨酸(H2NCH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
I.配制含0.10molFeSO4的绿矾溶液。
II.制备FeCO3:向配制好的绿矾溶液中,缓慢加入200mL1.1mol/LNH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
III.制备(H2NCH2COO)2Fe:实验装置如下图(夹持和加热仪器已省略),将实验II得到的沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中反应产生的气体将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
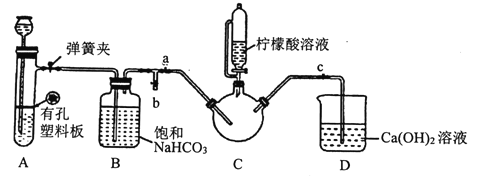
回答下列问题:
(1)实验I中:实验室配制绿矾溶液时,为防止FeSO4被氧化变质,应加入的试剂为____(写化学式)。
(2)实验II中:生成沉淀的离子方程式为________________。
(3)实验III中:
①检查装置A的气密性的方法是_________。
②装置A中所盛放的药品是_______ (填序号)。
a.Na2CO3和稀H2SO4 b.CaCO3和稀H2SO4 c.CaCO3和稀盐酸
③确认c中空气排尽的实验现象是______________。
④加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是_______。
⑤洗涤实验III中得到的沉淀,所选用的最佳洗涤试剂是___(填序号)。
a.热水 b.乙醇溶液 c.柠檬酸溶液
⑥若产品的质量为17.34g,则产率为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下:

(1)MgCO3 与稀硫酸反应的化学方程式为__________________________。
(2)加入H2O2 氧化时,发生反应的离子方程式为__________________________。
(3)滤渣2 的成分是____________(填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C![]() 2MgO+2SO2↑+CO2↑ MgSO4+C
2MgO+2SO2↑+CO2↑ MgSO4+C![]() MgO+SO2↑+CO↑ MgSO4+3C
MgO+SO2↑+CO↑ MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。

①D中通过排水法收集的气体可以是___________(填化学式)。
②C中溶液用于吸收CO2,B中盛放的溶液可以是___________(填字母)。
a.NaOH 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. lmol单质Fe与足量的高温水蒸气反应,失去3NA个电子
B. 27g铝中加入1L 1 mol/L的NaOH溶液,转移电子数是3NA
C. 50mll2mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
D. 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】滴定是分析化学中最要的分析方法之一,根据其原理回答下列问题:
I、酸碱中和滴定是最基本的滴定方法:
(1)滴定管是酸碱中和滴定中重要的仪器,向25mL碱式滴定管中加入氢氧化钠溶液,开始时滴定管的读数为10.00mL,将滴定管中的液体全部放出,放出氢氧化钠溶液的体积为____________(填“大于”、“小于”或“等于”)15.00mL。
(2)向碱式滴定管中注入标准的氢氧化钠溶液之前的一步操作为(_______________)
(3)准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.1000 mol/LNaOH溶液滴定。下列说法正确的是(______)
A.锥形瓶用蒸馏水洗涤后,用待测HCl溶液润洗
B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏大
II、氧化还原滴定也是分析化学中常用的分析手段,用氧化还原滴定方法测定粗品中Na2S2O35H2O的质量分数。
实验步骤:称取6g粗品配制250mL的溶液待用。用酸式滴定管取25.00mL0.01mol/L K2Cr2O7溶液于锥形瓶中,然后加入过量的KI溶液并酸化,加几滴淀粉溶液,立即用配制的Na2S2O3溶液滴定至终点(反应为I2+2S2O32-=2I﹣+S4O62﹣),消耗Na2S2O3溶液25.00mL。回答下列问题:
(1)向K2Cr2O7溶液中加入过量的KI溶液并酸化,Cr2O72-被还原成Cr3+,写出该反应的离子方程式_____。
(2)用Na2S2O3溶液滴定至终点的现象为_________________________。
(3)粗品中Na2S2O35H2O的质量分数为___________________。
(4)若在取K2Cr2O7溶液时有部分溶液滴到了锥形瓶外,则测定结果偏_________(填“高”、“低”或“不变”)
查看答案和解析>>
科目: 来源: 题型:
【题目】 A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:

(1)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式:_________________。
(2)若D物质具有两性,②、③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出反应③的离子方程式:______________。
(3)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写出该反应的离子方程式:______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com