
科目: 来源: 题型:
【题目】(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)![]() 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。
①能说明该反应已达到平衡状态的标志是___。
a.反应速率v(NH3)=v(N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO)∶n(NH3)∶n(N2)∶n(H2O)=6∶4∶5∶6
e.12mol N-H键断裂的同时生成5mol N≡N键
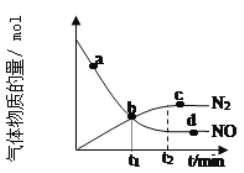
②某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中b点对应的速率关系是v(正)___v(逆);d点对应的速率关系是v(正)___v(逆)。(填﹥、﹤或﹦)。
(2)一定条件下,在2L密闭容器内,反应2NO2(g)![]() N2O4(g),n(NO2)随时间变化如下表:
N2O4(g),n(NO2)随时间变化如下表:
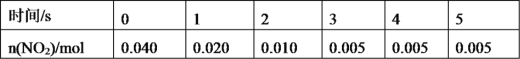
①用N2O4表示0~2s内该反应的平均速率为___。在第5s时,NO2的转化率为___。
②根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) △H1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) △H2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) △H3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式___。
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。

①b点时,平衡体系中C、N原子个数之比接近___;
②a、b、c三点CO的转化率从大到小的顺序为___;a、c、d三点的平衡常数从大到小的顺序为___。
③若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为__。
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极处通入的气体为____(填化学式);A电极的电极反应式为____;一段时间后,若乙中需加0.2molCu(OH)2使溶液复原,则转移的电子数为___。
(4)已知:25℃时,H2C2O4的电离常数Ka1=5.9×10—2,Ka2=6.4×10-5,则25℃时,0.1mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为____,若向该溶液中加入一定量NaOH固体,使c(HC2O4-)=c(C2O42-),则此时溶液呈___(填“酸性”“碱性”或“中性”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2是一种高效、广谱、安全的杀菌、消毒剂,易溶于水。制备方法如下:
(1)步骤Ⅰ:电解食盐水制备氯酸钠。用于电解的食盐水需先除去其中的 Ca2+、Mg2+、SO42-等杂质。在除杂操作时,往粗盐水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的________和NaOH,充分反应后将沉淀一并滤去。
(2)步骤Ⅱ:将步骤Ⅰ得到的食盐水在特定条件下电解得到氯酸钠(NaClO3),再将它与盐酸反应生成ClO2与Cl2,ClO2与Cl2的物质的量比是____________。
(3)学生拟用左下图所示装置模拟工业制取并收集ClO2,用NaClO3和草酸(H2C2O4)恒温在60℃ 时反应制得。

反应过程中需要对A容器进行加热,加热的方式为____________;加热需要的玻璃仪器除酒精灯外,还有_________________;
(4)反应后在装置C中可得亚氯酸钠(NaClO2)溶液。已知NaClO2饱和溶液在温度低于38℃时,析出的晶体是NaClO2·3H2O,在温度高于38℃时析出的是NaClO2。根据右上图所示NaClO2的溶解度曲线,请完成从NaClO2溶液中制得NaClO2·3H2O的操作步骤:
①_____________;②_______________;③洗涤;④干燥。
(5)目前我国已成功研制出利用NaClO2制取二氧化氯的新方法,将Cl2通入到NaClO2溶液中。现制取270kg二氧化氯,需要亚氯酸钠的质量是________。
(6)ClO2和Cl2均能将电镀废水中的剧毒CN-氧化为无毒物质,自身被还原为Cl-。处理含CN-相同量的电镀废水,所需Cl2的物质的量是ClO2的_______倍。
查看答案和解析>>
科目: 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。下列有关说法正确的是

A. 正极反应式:Ca + 2Cl--2e- = CaCl2
B. 放电过程中,Li+向负极移动
C. 没转移0.1mol电子,理论上生成20.7 g Pb
D. 常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是

A.在0-50min之间, pH =2 和 PH= 7 时 R 的降解百分率相等
B.溶液酸性越强, R 的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在 20-25min之间, pH = 10 时 R 的平均降解速率为 0.04mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,用0.10mol·L-1盐酸分别滴定20.00mL 0.10 mol·L-1氢氧化钾溶液和氨水,滴定过程中溶液pH随加入盐酸体积V(HCl)的变化关系如图。下列说法不正确的是( )
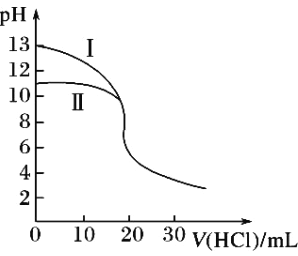
A. Ⅱ表示的是滴定氨水的曲线
B. 当pH=7时,滴定氨水消耗的V(HCl)<20mL,且此时溶液中c(NH4+)=c(Cl-)
C. 滴定氢氧化钾溶液时,若V(HCl)>20mL,则可能c(Cl-)>c(H+)>c(K+) >c(OH-)
D. 当滴定氨水消耗V(HCl)=10mL时,c(NH3H2O)>c(NH4+)>c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】某反应由两步反应A![]() B
B![]() C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述不正确的是( )
C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述不正确的是( )
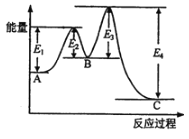
A. A→C的反应为放热反应 B. 稳定性C>A>B.
C. A→C的反应中,△H=(E2+E4)-(E1+E3) D. 加入催化剂不会改变反应的焓变
查看答案和解析>>
科目: 来源: 题型:
【题目】为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
[探究一]
(1)常温下,可以用铁质容器盛放冷的浓硫酸,其原因是__;
(2)称取碳素钢6g放入15mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学队为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用___(选填序号)。
A.KSCN溶液和氯水 B.铁粉和KSCN溶液 C.浓氨水 D.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4反应,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g,由此推知气体Y中SO2的体积分数为__。
[探究二]根据上述实验中SO2体积分数的分析,丙同学认为气体Y中除SO2外还可能含有Q1和Q2两种气体,其中Q1气体,存标准状况下密度为0.0893g/L。为此设计了下列探究实验装置(假设有关气体完全反应)。
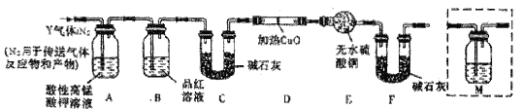
(3)装置B中试剂的作用是___。
(4)分析Y气体中的Q2气体是如何生成的___(用化学方程式表示)。
(5)已知洗气瓶M中盛装澄清石灰水,为确认Q2的存在,需在装置中添加M于____(填序号)。
A.A之前 B.A—B间 C.B—C间 D.C—D间
(6)确认Q1气体存在的实验现象是____。
[探究三]如图是实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。
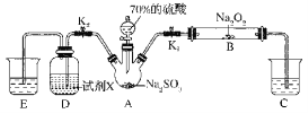
(7)下列有关说法不正确的是___
A.关闭K2,打开Kl,滴加硫酸,则装置B中每消耗1molNa2O2,转移电子数为2NA
B.关闭Kl,打丌K2,试剂X是酸性KmnO4或FeCl3溶液,均可证明SO2有还原性
C.为防止环境污染,装置C和E中的试剂均取用NaOH溶液
D.实验过程中体现了硫酸的酸性、吸水性、难挥发性、强氧化性
查看答案和解析>>
科目: 来源: 题型:
【题目】向xmL 0. 1 mol/L氨水中滴加等物质的量浓度的稀H2SO4 ,测得混合溶液的温度和pOH[pOH==-lg c(OH-)]随着加入稀硫酸的体积的变化如图所示(实线为温度变化,虚线为pOH变化)。下列说法不正确的是

A. x=40
B. a, b,c三点由水电离出的c(H+)依次减小
C. b点时溶液的pOH>pH
D. a,b.d三点对应的NH3·H2O的电离常数:K(b)>K(d)>K(a)
查看答案和解析>>
科目: 来源: 题型:
【题目】在含有Ag+的酸性溶液中,以铁铵矾NH4Fe(SO4)2作指示剂,用KSCN的标准溶液滴定Ag+.已知:AgSCN(白色s)![]() Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-
Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-![]() [Fe(SCN)] 2+(红色),K=138。下列说法不正确的是( )
[Fe(SCN)] 2+(红色),K=138。下列说法不正确的是( )
A. 边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀
B. 当Ag+定量沉淀后,少许过量的SCN-与Fe3+生成红色配合物,即为终点
C. 上述实验可用KCl标准溶液代替KSCN的标准溶液滴定Ag+
D. 滴定时,必须控制溶液一定的酸性,防止Fe3+水解,影响终点的观察
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com