
科目: 来源: 题型:
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图:
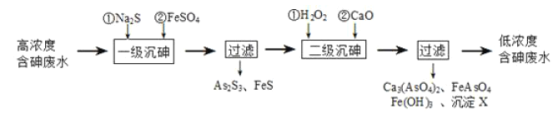
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为____;砷酸的第一步电离方程式为______。
(2)“一级沉砷”中FeSO4的作用是_____;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_______。
(3)沉淀X为____(填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
(4)AsH3的电子式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】完成下列填空。
(1)100ml0.1mol/L的Na2SO4溶液中所含Na+的数目为___。
(2)同温同压下,同体积的甲烷和二氧化碳分子数之比为___,密度之比为___。
(3)某气态氧化物化学式为RO2,在标准状况下,1.28g该氧化物的体积是448mL,则氧化物的摩尔质量为__,R的相对原子质量为___。
查看答案和解析>>
科目: 来源: 题型:
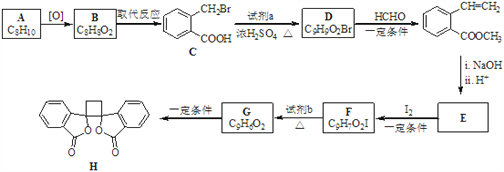
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如下图所示:
已知:i.RCH2Br ![]() R﹣HC═CH﹣R′
R﹣HC═CH﹣R′
ii.R﹣HC═CH﹣R′![]()
![]()
iii.R﹣HC═CH﹣R′![]()
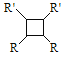
(以上R、R'、R'代表氢、烷基或芳基等)
(1)A属于芳香烃,其名称是_______________________。
(2)D的结构简式是_______________________________。
(3)由F生成G的反应类型是________________________________________。
(4)由E与I2在一定条件下反应生成F的化学方程式是_____________________;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是_______________________________。
(5)下列说法正确的是___________(选填字母序号)。
A. G存在顺反异构体
B. 由G生成H的反应是加成反应
C. 1 mol G最多可以与1 mol H2发生加成反应
D. 1 mol F或1 mol H与足量NaOH溶液反应,均消耗2 molNaOH
(6)以乙烯为起始原料,结合已知信息选用必要的无机试剂合成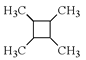 写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___________________
写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___________________
查看答案和解析>>
科目: 来源: 题型:
【题目】CO 还原脱硝技术可有效降低烟气中的NOx的排放量。回答下列问题:
I.CO 还原NO 的脱硝反应:2CO(g)+2NO(g) ![]() 2CO2(g)+N2(g) △H
2CO2(g)+N2(g) △H
(1)汽车在行驶过程中会产生有害气体CO、NO,它们之间能发生上述反应:
① 该反应平衡常数K表达式为_________;
② 该反应的K极大(570 K时为1×1059),但汽车上仍需装备尾气处理装置,其可能原因是_______;
(2)以Mn3O4 为脱硝反应的催化剂,研究者提出如下反应历程,将历程补充完整。
第一步:_________;
第二步:3MnO2+2CO=Mn3O4+2CO2
(3)在恒温恒容的密闭容器中,充入等物质的量的CO 和NO 混合气体,加入Mn3O4 发生脱硝反应,t0 时达到平衡,测得反应过程中CO2 的体积分数与时间的关系如右图所示。
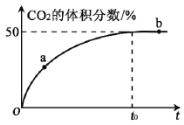
① 比较大小:a处v正______b处v逆(填“>”、“<”或“=”)
② NO 的平衡转化率为_______。
II.T℃时,在刚性反应器中发生如下反应:CO(g)+NO2(g) ![]() CO2(g)+NO(g),化学反应速率v =kPm(CO)Pn( NO2),k 为化学反应速率常数。研究表明,该温度下反应物的分压与化学反应速率的关系如下表所示:
CO2(g)+NO(g),化学反应速率v =kPm(CO)Pn( NO2),k 为化学反应速率常数。研究表明,该温度下反应物的分压与化学反应速率的关系如下表所示:
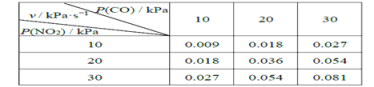
(4)若反应初始时P(CO)=P(NO2)=a kPa,反应t min时达到平衡,测得体系中P(NO)=b kPa,则此时v=_________kPa·s-1(用含有a和b的代数式表示,下同),该反应的化学平衡常数Kp=_________(Kp是以分压表示的平衡常数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol/LCH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中c(CH3COO-)/c(CH3COOH)·c(OH-)增大
C. 向盐酸中加入氨水至中性,溶液中c(NH4+)/c(Cl-)>1
D. 向AgCl、AgBr的饱和溶液中加入少量硝酸银,溶液中c(Cl-)/c(Br-)不变
查看答案和解析>>
科目: 来源: 题型:
【题目】碳及其化合物广泛存在于自然界。请回答下列问题:
(1)海洋是地球上碳元素的最大吸收池。
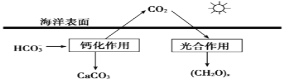
①溶于海水中的CO2主要以四种无机碳形式存在,即:CO2、H2CO3、___________、___________。
②在海洋碳循环中,可通过如上图所示的途径固碳。写出钙化作用的离子方程式___________。
(2)过量CO2溶解于海水将使许多海洋生物面临巨大威胁。研究者提出,用下图所示方法从海水中提取CO2,可以降低环境温室气体CO2的含量。
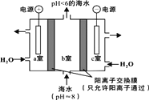
① a室的电极反应式是__________;
② 利用该装置产生的物质X可处理b室排出的海水,获得可排回大海的合格海水,X的化学式是__________。
(3)已知:NH3·H2O的Kb=1.7×10-5,H2CO3的Ka1=4.3×10-7、Ka2=5.6×10-11。工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至15.5℃~26.5℃后用氨水吸收过量的CO2。所得溶液的pH___________7(填“>”、“=”或“<”)。烟气需冷却至15.5℃~26.5℃的可能原因是____________。
(4)为了测量某湖水中无机碳含量,量取100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收。往吸收液中滴加1.0mol/L盐酸,生成的V(CO2)随V(盐酸)变化关系如图所示,则原吸收液中离子浓度由大到小的顺序为__________。
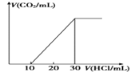
查看答案和解析>>
科目: 来源: 题型:
【题目】已知硝酸铵在不同温度下分解会有不同的产物,反应方程式如下,
①NH4NO3![]() NH3↑+HNO3↑②NH4NO3
NH3↑+HNO3↑②NH4NO3![]() N2O↑+2H2O↑
N2O↑+2H2O↑
③2NH4NO3![]() 2N2↑+O2↑+4X↑④4NH4NO3
2N2↑+O2↑+4X↑④4NH4NO3![]() 3N2↑+2NO2↑+8H2O↑
3N2↑+2NO2↑+8H2O↑
请回答下列问题:
(1)这四个反应中属于氧化还原反应的有___个。
(2)反应③中物质X的化学式是___。
(3)反应④中氧化产物和还原产物依次是___、___。(填化学式)
(4)若反应③生成标准状况下的11.2L氧气,则转移电子数为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置。
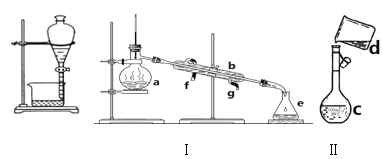
(1)写出下列仪器的名称:a.___,b.___,c.___,d.___。
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是___,冷凝水由___(填f或g)口通入。
(3)现需配制0.25mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是___。
②根据计算得知,需称量NaOH的质量为___g。
③下列操作使配制的NaOH溶液浓度偏低的有____。
A.将砝码放在左盘上,NaOH放在右盘上进行称量(使用游码)
B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线
D.整个配制过程中,容量瓶不振荡
查看答案和解析>>
科目: 来源: 题型:
【题目】在体积相同的三个容器里分别充入三种气体①H2②CO2③O2,并保持三个容器内气体的温度和密度均相等,下列说法正确的是( )
A.压强关系:①>③>②B.质量关系:①<③<②
C.分子数目:①=②=③D.原子数目:②>③>①
查看答案和解析>>
科目: 来源: 题型:
【题目】(13分)用辉铜矿(主要成分为 Cu2S,含少量Fe2O3、SiO2,等杂质)制备难溶于水的碱式碳酸铜的流程如下:
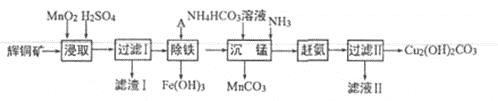
(1)下列措施是为了加快浸取速率,其中无法达到目的的是____(填字母)。
A.延长浸取时间 | B.将辉铜矿粉碎 |
C.充分搅拌 | D.适当增加硫酸浓度 |
(2)滤渣I巾的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的离子方程式:_______。
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,可能的原因是___________。
(4)“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3,则加入的试剂A可以是_______(填化学式);“赶氨”时,最适宜的操作方法是________。
(5)“沉锰”(除Mn2+)过程中有关反应的离子方程式为_______。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是___________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com