
科目: 来源: 题型:
【题目】已知非金属元素A、B、C、D、E均属于短周期元素,其原子序数依次增大,A元素原子形成的离子核外电子数为零,B原子的最外层电子数是内层电子数的2倍,通常状况下E的单质是黄色晶体,不溶于水,易溶于二硫化碳,D与E在同一主族,C、D在周期表中处于相邻的位置,请回答下列问题:
(1)A元素的名称是________,E的阴离子结构示意图是__________________。
(2)元素C的最高价氧化物对应水化物与其气态氢化物反应生成化合物Z,该反应的离子方程式为____________________________________________,化合物Z属于________________(填“离子化合物”或“共价化合物”),Z中含有的化学键类型是________________。
(3)C元素的最高价氧化物对应的水化物的稀溶液能与D、E元素形成的一种化合物发生氧化还原反应,其离子反应方程式为__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用“>”、“<”或“=”填空:
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),光照和点燃条件的ΔH(化学计量数相同)分别为ΔH1、ΔH2,ΔH1______ΔH2;
(2)相同条件下,2mol氢原子所具有的能量____1mol氢分子所具有的能量;
(3)已知常温时红磷比白磷稳定,比较下列反应中ΔH的大小:ΔH1_____ΔH2。
①4P(白磷,s) +5O2(g)=2P2O5(s) ΔH1,②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;
(4)已知:101 kPa时,2C(s) +O2(g)=2CO(g) ΔH=-221kJ·mol-1,则碳的燃烧热数值____110.5 kJ·mol-1;
(5)已知:稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,则浓硫酸与稀NaOH溶液反应生成1 mol水,放出的热量________57.3 kJ;
(6)可逆反应:aA(气)+bB(气)![]() cC(气)+dD(气);ΔH=Q,根据图回答:
cC(气)+dD(气);ΔH=Q,根据图回答:

P1______ P2;②(a+b)______(c+d);③t1℃______ t2℃。
查看答案和解析>>
科目: 来源: 题型:
【题目】以石油化工产品为原料合成聚酯类功能高分子材料R及某药物合成原料E的一种合成路线如下(部分反应条件和产物略去):
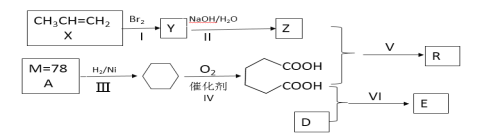
已知D与乙醇属于同系物,E在核磁共振氢谱上有3组峰且峰面积比为2∶2∶3
回答下列问题:
(1)Y的名称是____;R的官能团名称是____;E的分子式是__________。
(2)反应Ⅵ的反应类型是_____;X最多有___________个原子共面。
(3)写出II反应的化学方程式__________________。
(4)写出Y的其余几种同分异构体_________________。
(5)已知: ![]() ,参照上述合成路线,以甲苯和溴乙烷为原料合成苯甲酸乙酯,合成路线是:___________。
,参照上述合成路线,以甲苯和溴乙烷为原料合成苯甲酸乙酯,合成路线是:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列数据:
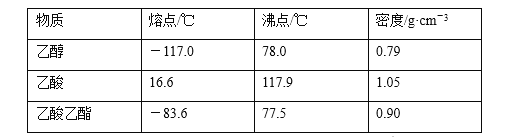
某学生在实验室制取乙酸乙酯的主要步骤如下:
①配制2 mL浓硫酸、3 mL乙醇和2 mL乙酸的混合溶液。
②按图连接好装置(装置气密性良好)并加入混合液,用小火均匀加热3~5 min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥、蒸馏。最后得到纯净的乙酸乙酯。
(1)反应中浓硫酸的作用是_________。
(2)写出制取乙酸乙酯的化学方程式:_________。
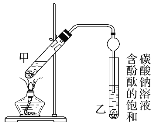
(3)上述实验中饱和碳酸钠溶液的作用是________。
(4)步骤②为防止加热过程中液体爆沸,该采取什么措施__________。
(5)欲将乙试管中的物质分离以得到乙酸乙酯,必须使用玻璃的仪器有____;分离时,乙酸乙酯应从仪器_____(填“下口放”或“上口倒”)出。
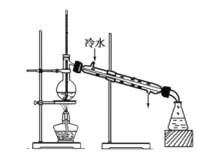
(6)通过分离后饱和碳酸钠中有一定量的乙醇,拟用图回收乙醇,回收过程中应控制温度是_____;找出图中的错误_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
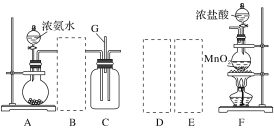
备选装置 | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
请回答下列问题:
(1)装置F中发生反应的离子方程式是___________________________________。
(2)装置A中的烧瓶内固体可选用________(填字母)。
A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从如图的备选装置中选择,并将编号填入下列空格:
B:________、D:________、E:________。
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为:____________________________________;
(5)装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案确定该白色固体中的阳离子:_______________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组同学为探究同周期或同主族元素性质的递变规律,设计了如下系列实验:
Ⅰ.(1)将等质量的钾、钠、镁、铝分别投入到足量的同浓度的盐酸中,试预测实验结果:上述金属中_____与盐酸反应最剧烈,_____与盐酸反应生成的气体最多。
(2)向Na2S溶液中通入氯气出现淡黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为_____________________________________。
Ⅱ.利用图装置来验证同主族元素非金属性的变化规律:
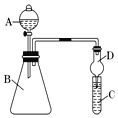
(1)要证明非金属性:Cl>I,在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液_____________的现象,即可证明。干燥管D的作用是_________________。从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用_____溶液吸收尾气。
(2)要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,应在B、D之间增加一个盛有足量_____(选填下列字母:A.浓盐酸 B.浓NaOH溶液C.饱和Na2CO3溶液 D.饱和NaHCO3溶液)的洗气装置。改进后C中发生反应的化学方程式是__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】遵义市某些地区出现了不同程度的雾霾天气,我校课题小组的同学对其进行了调查研究,
Ⅰ.课题小组研究发现,其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。
(1)25℃时将PM2.5样本用蒸馏水处理制成待测溶液。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
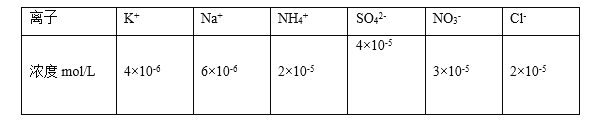
根据表中数据判断试样的pH=________。
Ⅱ.课题组就其酸性物质做进一步研究
一氧化氮、二氧化氮的研究
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应:
2NO(g)+O2(g) ![]() 2NO2(g),下列状态能说明该反应达到化学平衡的是_______(填字母编号)。
2NO2(g),下列状态能说明该反应达到化学平衡的是_______(填字母编号)。
A.混合气体的密度保持不变 B.NO的转化率保持不变
C.NO和O2的物质的量之比保持不变 D.O2的消耗速率和NO2的消耗速率相等
(2)活性炭可处理大气污染物NO,反应原理为:C(s)+2NO(g)![]() N2(g)+CO2(g),T℃时,在2L密闭容器中加入0.100mol NO和2.030mol活性炭(无杂质),平衡时活性炭物质的量是2.000mol,则该温度下的平衡常数为_________;达平衡时,若再向容器中充入0.04molNO,0.03molN2和0.03molCO2,则平衡________移动。(填“向左”“向右”或“不”)
N2(g)+CO2(g),T℃时,在2L密闭容器中加入0.100mol NO和2.030mol活性炭(无杂质),平衡时活性炭物质的量是2.000mol,则该温度下的平衡常数为_________;达平衡时,若再向容器中充入0.04molNO,0.03molN2和0.03molCO2,则平衡________移动。(填“向左”“向右”或“不”)
III.一氧化碳、二氧化碳的研究
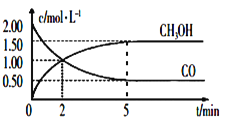
(1)CO或CO2在一定条件下可以用来合成甲醇。工业上常用CO和H2制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。从反应开始到5min,用H2表示的平均反应速率v(H2)=_____。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。从反应开始到5min,用H2表示的平均反应速率v(H2)=_____。
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △ H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △ H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △ H= - 178.3kJ/mol
①计算反应Ⅳ:C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=______kJ/mol;
CaCO3(s)+2H2(g)的△H=______kJ/mol;
对硫的氧化物的研究
②SO2可被Na2FeO4氧化而去除污染,工业上用Fe和石墨作电极电解浓NaOH溶液制备Na2FeO4。写出电解过程中阳极发生的电极反应________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某烃类化合物A用仪器可以测出其相对分子质量为84,分子中含有碳碳双键,分子中只有一种类型的氢。
(1)现有以下的实验室仪器:
A.1H核磁共振仪 B.质谱仪
C.红外光谱仪 D.元素分析仪
请你选择分别用什么仪器
①测出相对分子质量________(填字母,下同)。
②测出官能团碳碳双键________。
③测出几种类型的氢________。
(2)结合题给信息,可以判断A的结构简式为________。
(3)在如图中,D1、D2互为同分异构体,E1、E2互为同分异构体。
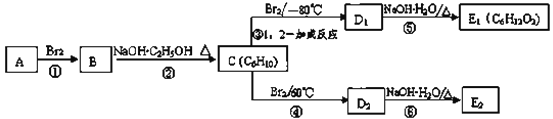
反应②的化学方程式为_________;
C的化学名称为__________;反应类型为:__________。
E2的结构简式是_________;
④、⑤的反应类型依次是________、_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是25℃时某些弱酸额的电离平衡常数。

(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈______(填“酸性”、“碱性”或“中性”),该溶液中各离子浓度由大到小的顺序为_______。
(2)向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=_______。
(3)向碳酸钠溶液中滴加少量氯水的离子方程式为________。
(4)若0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(CH3COO-)=_______mol/L(填精确计算结果)。
(5)将CH3COOH溶液与大理石反应所产生的标况下44.8L气体全部通入到2L1.5mol/L的NaOH溶液中充分反应,则溶液中所有离子的物质的量浓度关系为______。
(6)已知某温度下,0.10mol/LNH4Cl溶液的pH=5,则该温度下NH3·H2O的电离常数约为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com