
科目: 来源: 题型:
【题目】氮、磷、硫、氯的化合物种类繁多,应用广泛。
(1)工业中可用POF3合成杀虫农药,组成该物质的三种元素的电负性由大到小的顺序是______。
(2)普鲁士蓝的化学式是KFe[Fe(CN)6],该物质存在的化学键有离子键、共价键和_____。
(3)KCN可被H2O2氧化为KOCN
①KOCN可作为制药原料,其晶体类型是离子晶体;碳原子采取sp杂化,1mol该物质中含有的π键数目为____。
②H2O2常温下是液体,沸点较高(150℃),其主要原因是____。
(4)SO3和O3的混合气体经光解作用,可生成一种结构如图所示的物质,该物质中S原子的轨道杂化方式是____,该分子属于___(填“极性分子”或“非极性分子”)。

查看答案和解析>>
科目: 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法正确的是( )
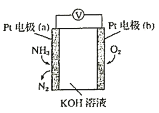
A.O2在电极b上发生氧化反应
B.溶液中OH-向电极b移动
C.反应消耗的NH3与O2的物质的量之比为4:3
D.正极的电极反应式为2NH3-6e-+6OH-=N2+6H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】利用固体表面催化工艺进行NO分解的过程如下图所示。
![]()
下列说法不正确的是
A.NO属于共价化合物
B.O2含有非极性共价键
C.过程②吸收能量,过程③释放能量
D.标准状况下,NO分解生成11.2LN2转移电子数为6.02×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应![]() ,在容积固定的密闭容器中达到平衡状态的标志是( )
,在容积固定的密闭容器中达到平衡状态的标志是( )
①单位时间内生成![]() 的同时生成
的同时生成![]()
②单位时间内生成![]() 的同时生成
的同时生成![]()
③用![]() 表示的反应速率之比为
表示的反应速率之比为![]() 的状态
的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的物质的量不再改变的状态
A.①④⑥⑦B.②③⑤⑦C.①③④⑤D.全部
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验方案能达到实验目的的是(部分夹持装置已略去)
|
|
|
|
A证明醋酸酸性比 硼酸强 | B实验室制 氢氧化亚铁 | C实验室制氨气 | D证明碳酸氢钠热稳定 性比碳酸钠弱 |
A.AB.B…C.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】氢化铵(NH4H)与氯化铵的结构相似,又知它与水反应有气体生成。下列关于氢化铵叙述正确的是( )
A.氢元素的化合价都是![]() 价B.电子式是
价B.电子式是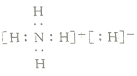
C.与水反应时,是氧化剂D.固体投入少量的水中,只产生一种气体NH3
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:

(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为_______,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为_______。
(2)三种晶体中熔点最低的是________,其晶体受热熔化时,克服的微粒之间的相互作用为________。
(3)结合CaF2晶体的晶胞示意图,已知,两个距离最近的Ca2+核间距离为a×10-8 cm,计算CaF2晶体的密度为________g·cm-3(精确到小数点后一位数,NA用具体数字代进去计算)。
查看答案和解析>>
科目: 来源: 题型:
【题目】镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。
Ⅰ.羰基法提纯粗镍涉及的两步反应依次为:
①Ni(S)+4CO(g)![]() Ni(CO)4(g) ②Ni(CO)4(g)
Ni(CO)4(g) ②Ni(CO)4(g)![]() Ni(S)+4CO(g)
Ni(S)+4CO(g)
完成下列填空:
(1)在上述反应中断裂或形成的化学键有____(填序号)。
A.离子键 B.配位键 C.非极性共价键 D.金属键
(2)比较C元素和O元素分别形成的最简单气态氢化物的稳定性大小________。
(3)C、O、Ni元素的电负性由大到小排列顺序为______。
(4)化合物Ni(CO)4呈正四面体构型,Ni(CO)4中Ni原子的杂化类型为____。
(5)基态Ni原子的外围电子排布式___,价电子的轨道表示式为__________。
Ⅱ.研究金属镍及其化合物晶体结构具有重要意义。
(6)NiO、FeO的晶体结构类型均与氯化钠的相同,且Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO_______FeO(填“<”或“>”);
查看答案和解析>>
科目: 来源: 题型:
【题目】550℃时,有如下反应:2SO2+O2![]() 2SO3 ΔH<0。把2molSO2和1molO2放入恒容的密闭容器中,判断该反应达到平衡状态的标志是( )
2SO3 ΔH<0。把2molSO2和1molO2放入恒容的密闭容器中,判断该反应达到平衡状态的标志是( )
A. SO2和SO3浓度相等
B. 单位时间内反应掉0.2molSO2的同时生成了0.2molSO3
C. 容器中气体的压强不变
D. 容器中混合气体的密度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com