
科目: 来源: 题型:
【题目】温度为T时,在三个容积均为1L的恒容密闭容器中仅发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
容器 编号 | 容器类型 | 起始物质的量 / mol | 平衡时SO3的物质的量 / mol | ||
SO2 | O2 | SO3 | |||
I | 恒温恒容 | 2 | 1 | 0 | 1.8 |
II | 恒温恒压 | 2 | 1 | 0 | a |
III | 绝热恒容 | 0 | 0 | 2 | b |
A. 容器I中SO2的转化率小于容器II中SO2的转化率
B. 容器II的平衡常数大于容器III中的平衡常数
C. 平衡时SO3的物质的量:a>1.8、b>1.8
D. 若起始时向容器I中充入0.10 mol SO2(g)、0.20mol O2(g)和2.0 mol SO3(g),则此时v正<v逆
查看答案和解析>>
科目: 来源: 题型:
【题目】NO用途广泛,对其进行研究具有重要的价值和意义
(1)2NO(g)+O2(g)=2NO2(g)△H=akJmol-1的反应历程与能量变化关系如图所示。已知:第Ⅱ步反应为:NO3(g)+NO(g)=2NO2(g)△H=bkJmol-1
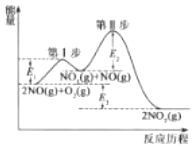
①第I步反应的热化学方程式为__。
②关于2NO(g)+O2(g)=2NO2(g)的反应历程,下列说法正确的是__。
A.相同条件下,决定该反应快慢的步骤为第Ⅱ步反应
B.使用合适的催化剂会使E1、E2、E3同时减小
C.第I步反应为吸热反应,第Ⅱ步反应为放热反应
D.反应的中同产物是NO3和NO
(2)NO的氢化还原反应为2NO(g)+2H2(g)N2(g)+2H2O(g)。研究表明:某温度时,v正=kcm(NO)cn(H2),其中k=2.5×103mol(m+n-1)L(m+n-1)s-1.该温度下,当c(H2)=4.0×10-3molL-1时,实验测得v正与c(NO)的关系如图一所示,则m=___,n=___。
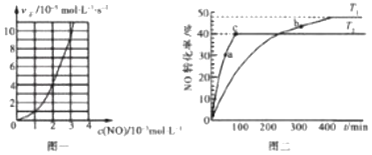
(3)NO易发生二聚反应2NO(g)N2O2(g)。在相同的刚性反应器中充入等量的NO,分别发生该反应。不同温度下,NO的转化率随时间(t)的变化关系如图二所示。
①该反应的△H___0(填“>”“<”或“=”)。
②T1温度下,欲提高NO的平衡转化率,可采取的措施为__(任写一条即可)。
③a、b处正反应速率va__vb(填”>”“<”或“=”),原因为___。
④e点对应体系的总压强为200kPa,则T2温度下,该反应的平衡常数kp=___kPa-1(Kp为以分压表示的平衡常数)
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应mA(s) + nB(g) ![]() eC(g) + f D(g),当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是
eC(g) + f D(g),当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是
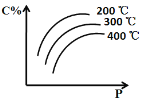
A. 化学方程式中n<e +f
B. 达到平衡后,若升温,v正减小,v逆增大
C. 达到平衡后,增加B的量,B的转化率增大
D. 若B为有色物质,达到平衡后缩小容器体积,重新达平衡后与原平衡比较气体颜色变浅
查看答案和解析>>
科目: 来源: 题型:
【题目】闪烁着银白色光泽的金属钛(22Ti)因具有密度小、强度大、无磁性等优良的机械性能,被广泛应用于军事、医学等领域,号称“崛起的第三金属”。已知钛有48Ti、49Ti、50Ti等同位素,下列关于金属钛的叙述中不正确的是( )
A.上述钛原子中,中子数不可能为22
B.钛元素在元素周期表中处于第四周期
C.钛的不同同位素在元素周期表中处于不同的位置
D.钛元素属于过渡元素
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,用0.100molL-1NaOH溶液分别滴定20.00mL0.100molL-1的HA和HB两种酸溶液,滴定曲线如图所示[已知AG=lg![]() ],下列说法不正确的是( )
],下列说法不正确的是( )

A.P点时,加入NaOH溶液的体积为20.00mL
B.Ka(HB)的数量级为10-4
C.水的电离程度:N>M=P
D.M、P两点对应溶液中存在:c(A-)=c(B-)
查看答案和解析>>
科目: 来源: 题型:
【题目】现有含NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液.相应过程用如图表示:
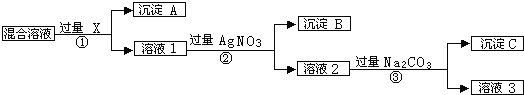
(1)写出下列物质的化学式X__________;
(2)写出步骤③涉及到的离子反应__________,__________;
(3)按此实验方案得到的溶液3中肯定含有杂质,为了解决这个问题,可以向溶液3中加入适量的__________(填化学式),之后若要获得固体NaNO3需进行的实验操作是__________(填操作名称).
查看答案和解析>>
科目: 来源: 题型:
【题目】O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等温等压下,等质量的O2和O3所含分子个数比为________,原子个数比为________,体积之比为________。
(2)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是________(用含NA的式子表示)。
(3)配制500 mL 1 mol/L的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84 g/mL,质量分数为98%)的体积为________ mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】标准状况下有①6.72 L CH4;②3.01×1023个HCl分子;③7.2 g H2O,下列对这三种物质的关系从小到大的排列顺序是:
(1)物质的量______;
(2)体积______;
(3)质量______;
(4)氢原子数______。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1 L 0.5 mol/L Na2CO3溶液中含有的CO32-数目为0.5NA
B. 物质的量浓度为0.5mol/LAlCl3溶液中,含有Cl-个数为1.5NA
C. 6g乙烷中含有的共价键的数目为1.4NA
D. l mol甲基(- CH3)所含电子数为10NA
查看答案和解析>>
科目: 来源: 题型:
【题目】现用固体KOH配制0.1 mol/L的KOH溶液 480 mL,回答下列问题:
(1)配制过程中需要用到的玻璃仪器有______。
(2)需要用托盘天平称量______g KOH固体。
(3)如果在定容时仰视操作,则所配得溶液的浓度______0.1 mol/L(填>,=,<)。
(4)若所用的固体KOH中混有NaOH,则所配得溶液的c(OH-)浓度______0.1 mol/L (填>,=,<)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com