
科目: 来源: 题型:
【题目】某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池,得到的数据如下表所示:

实验编号 | 水果种类 | 电极间距离/cm | 电流大小/μA |
① | 西红柿 | 1 | 98.7 |
② | 西红柿 | 2 | 72.5 |
③ | 苹果 | 2 | 27.2 |
(1)该实验的目的是探究水果种类和________对水果电池电流大小的影响。
(2)上图所示的装置中,做负极的材料是______(填“锌片”或“铜片”),该装置给将_________转变为电能。
(3)能表明水果种类对电流大小有影响的实验编号是____和_______。
(4)请你再提一个可能影响水果电池电流大小的因素:______________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组利用环己烷设计以下有机合成(无机产物已略去),试回答下列问题:
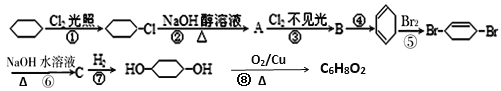
(1)写出下列化合物的结构简式:B:_______;C:_______;
(2)反应④所用的试剂和条件分别为:_______;
(3)反应⑤可能伴随的副产物有:_______(任写一种);
(4)写出以下过程的化学方程式,并注明反应类型:
④:_____________,反应类型 _______ ;
⑥:________________,反应类型 _____ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】某气态烃A与H2的相对密度为14,其产量可以用来衡量一个国家的石油化工发展水平。以该化合物为原料合成化合物G、E和I的流程如下:
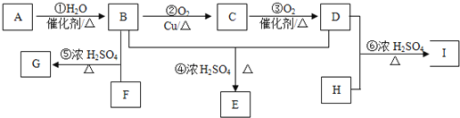
已知:Ⅰ.芳香族化合物F为C、H、O化合物,其相对分子质量为166,环上的一氯代物有一种,1molF与足量NaHCO3溶液反应能生成2molCO2,F与足量B反应生成G。
Ⅱ.H为二元醇,其蒸气密度折算成标准状况为2.77g/L,H与足量D反应生成I。
(1)A中官能团的名称为____________,E的结构简式_________________。
(2)G的分子式为_____________,反应⑤的反应类型为________________。
(3)写出下列化学方程式:②_______________________;
⑥___________________________。
(4)以乙烯为原料合成的加聚产物为![]() ,则单体是_______ 和_____。
,则单体是_______ 和_____。
(5)I有多种同分异构体,其中一类同分异构体有如下特征:
①分子中含有五元环结构;②1mol该有机物与足量NaHCO3溶液反应,能生成1 molCO2;③1mol该有机物与足量Na反应,能生成1.5 mol H2;④环上的一氯代物只有三种。则满足以上条件的有机物的所有可能的结构简式为:_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铝粉与氧化铁的混合物叫做铝热剂,发生的反应称为铝热反应:2Al+Fe2O3→2Fe+Al 2O3,可用于焊接铁轨。完成下列计算:
(1)若铝热剂中铝粉和氧化铁恰好完全反应,则该铝热剂中铝的质量分数为___。(精确到0.001)
(2)将8.1g铝粉与16g氧化铁混合后充分反应,最多可制得铁___g;将反应后的固体混合物加入足量的稀盐酸中,充分反应后最多可生成氢气____mol。
(3)23.52g某铝热剂在隔绝空气的条件下充分反应后,将固体溶解于200 mL5 mol/L的盐酸中,完全溶解后溶液中c(H+)=0.2mol/L(溶液体积变化忽略不计),且无Fe3+。计算该铝热剂中铝粉与氧化铁的物质的量分别是多少?___、___。
(4)取某铝热剂反应后的固体,滴加4mol/L的NaOH溶液,当加至30mL时固体质量不再减小,且剩余固体质量为7.2g,并收集到672 mL的氢气(标准状况)。计算原铝热剂中氧化铁的质量分数为多少?(精确到0.001)____
查看答案和解析>>
科目: 来源: 题型:
【题目】用化学用语回答下列问题
(1)画出钾原子的原子结构示意图:____________。
(2)写出氨分子的结构式:__________________。
(3)用电子式表示氟化钙(CaF2)的形成过程:_________________。
(4)完成下表
K层为最外层时,最多能容纳的电子数 | _________ |
除K层外,其他各层为最外层时,最多能容纳的电子数 | _________ |
次外层最多能容纳的电子数 | _________ |
倒数第3层最多能容纳的电子数 | _________ |
第n层里最多能容纳的电子数 | _________ |
查看答案和解析>>
科目: 来源: 题型:
【题目】氯吡格雷是一种用于抑制血小板聚集的药物,合成线路如图:
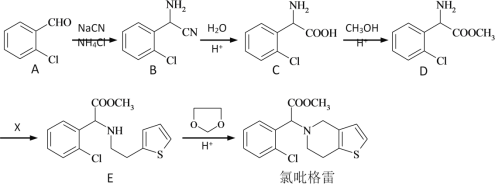
(1)C→D的反应类型____,X的化学式是(C6H7BrS),X的结构简式___。
(2)写出C聚合成高分子化合物的结构简式___。
(3)E合成氯吡格雷的反应中,另一个有机产物的结构简式___。
(4)物质A的同系物G,比A多一个碳原子且苯环上一溴代物只有两种的可能结构有___种。
(5)已知①同一个碳原子上连有两个羟基是不稳定的,极易脱水转变为![]() ,②
,②![]() 中氯原子在水溶液中不水解,写出2-氯甲苯(
中氯原子在水溶液中不水解,写出2-氯甲苯( )经两步反应合成A的化学方程式。____,合成A时产生的有机副产物可能是____。
)经两步反应合成A的化学方程式。____,合成A时产生的有机副产物可能是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL稀盐酸。
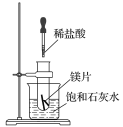
回答下列问题:
(1)实验中观察到的现象是________________。
(2)产生上述现象的原因是________________。
(3)写出有关反应的离子方程式____________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙炔是重要的化工原料,可以制得多种有机制品。用乙炔为原料制备PI(聚异戊二烯)的流程如图:
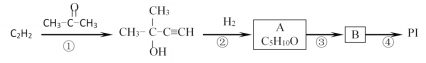
(1)有机物A中官能团的名称___,反应③的反应条件____。
(2)若将①中反应物“![]() ”改为“乙醛”,经过②③④后得到产物的结构简式是__。
”改为“乙醛”,经过②③④后得到产物的结构简式是__。
乙炔在一定条件下还可合成PVB塑料(聚乙烯醇缩丁醛):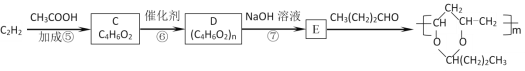
已知:-CHO+ +H2O
+H2O
(3)写出C的结构简式为__;2分子乙炔也能发生加成反应得到链烃,其反应产物的结构简式为___。
(4)反应⑦的化学方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国由海水提取的食盐(海盐)不足四成,大部分产自内陆盐湖(湖盐)和盐矿(矿盐)。
(1)由内陆盐湖水为原料进行晒盐,有“夏天采盐(食盐)、冬天捞硝(芒硝)”的说法,下列对其化学原理的描述正确的是___(选填编号)。
a.由夏到冬,芒硝的溶解度变小
b.由冬到夏,氯化钠的溶解度变小
c.夏天温度高,氯化钠易结晶析出
(2)芒硝型矿盐卤水中含有一定量Na2SO4和少量Ca2+、Mg2+、H2S等杂质,利用硫酸钙微溶于水的性质,用石灰-烟道气(CO2)法净化芒硝型矿盐卤水的流程如图:
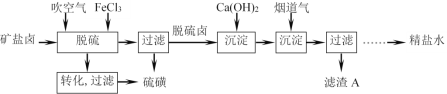
脱硫工序中先吹空气,发生物理和化学变化:物理变化是氢硫酸有挥发性,部分被直接吹出,化学变化是___(用化学方程式表示)。再加入稍过量的FeCl3溶液除去残留的硫化氢。检验FeCl3已经过量的试剂是___(填写化学式)。
(3)加入Ca(OH)2能降低芒硝浓度并生成烧碱,同时除去Fe3+,另一目的是___。滤渣A的主要成分除了Fe(OH)3外,还有___(填写化学式)。
(4)如图所示是石灰-纯碱法净化芒硝型矿盐卤水的部分流程:加入纯碱的作用是___(选填编号)。
a.调节溶液的pH b.除去溶液中的Ca2+
c.除去溶液中的Mg2+ d.除去溶液中的SO42―
石灰-烟道气法与石灰-纯碱法相比较,石灰-烟道气法的优点是___。

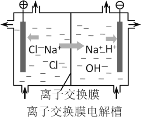
(5)如图是离子交换膜法电解食盐水的示意图,离子交换膜只允许阳离子通过,上述精盐水需要进行二次精制后才能作为离子交换膜电解槽的原料。对盐水进行二次精制的目的是___(选填编号)。
a.进一步降低Ca2+、Mg2+的浓度,提高烧碱纯度
b.进一步降低SO42―的浓度,提高烧碱纯度
c.防止杂质离子与碱生成的沉淀堵塞离子交换膜
d.防止溶液酸性或碱性过强,腐蚀离子交换膜
盐水中硫酸根浓度过高会使生成的氯气中混有氧气,检验氯气中是否含有少量氧气的操作是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用如图装置制备HCl气体。

(1)推压注射器活塞将浓盐酸慢慢注入到浓硫酸中,可制备少量干燥HCl气体,其原理是___(选填编号)。
a.浓硫酸吸收了盐酸中水分
b.混合时放热使HCl溶解度减小
c.浓盐酸中HCl以分子形式存在
d.浓盐酸密度小于浓硫酸
(2)为测定制备气体后残留混合酸中盐酸和硫酸的浓度,进行如下实验:取5.00mL混合酸,加水稀释至500mL,完成此操作,用到的精确定量仪器有____;称量4.7880gBa(OH)2固体,溶于水配成250mL标准溶液,装入洗净的细口试剂瓶,并贴上标签。装瓶前用标准溶液对试剂瓶进行润洗的目的是___,请你填写标签上的空白。____
![]()
(3)从500mL稀释液中取出20.00mL,滴加几滴酚酞作指示剂,用标准Ba(OH)2溶液滴定至溶液由无色变为红色才停止滴定,出现这种情况的补救措施除重做外,还有可以采取的措施是__。
(4)为完成全部测定,接下来对锥形瓶中混合物进行的操作是___、称量、___。
(5)若固体Ba(OH)2中混有少量的NaOH,会导致混合酸中硫酸浓度的测定结果___(选填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com