
科目: 来源: 题型:
【题目】如图所示,将大烧杯丙扣在甲乙两个小烧杯(口向上)上。向两个小烧杯中分别装入如下表所列的试剂进行实验。实验现象与预测现象不同的是
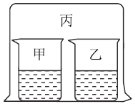
甲中试剂 | 乙中试剂 | 预测现象 | |
A | 浓盐酸 | 硝酸银溶液 | 乙中产生白色沉淀 |
B | 浓氨水 | 硫酸铁溶液 | 乙中产生红褐色沉淀 |
C | 浓盐酸 | 浓氨水 | 丙中产生白色烟雾 |
D | 氯化铝溶液 | 浓氨水并加入 固体氢氧化钠 | 甲中先产生白色沉淀,后又沉淀消失 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为_____________
(2)W与Y 可形成化合物W2Y,该化合物的电子式为________________________。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为_________________________。Y的最高价氧化物是否满足8电子稳定结构______________(填是.否)
(4)比较Y、Z气态氢化物的稳定性由大到小的顺序是________________(用分子式表示)。
(5)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是
____________________________________________________。(用离子符号表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
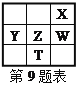
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
科目: 来源: 题型:
【题目】现代高科技领域使用的新型陶瓷材料氮化硼(BN),用天然硼砂(Na2B4O710H2O)经过下列过程可以制得。
天然硼砂![]() 硼酸(H3BO3)
硼酸(H3BO3)![]() B2O3
B2O3![]() BN
BN
(1)天然硼砂所含的元素中属于同一周期且原子半径是(用元素符号填写)___>___,由天然硼砂中的三种元素形成的某种离子化合物的电子式为______。
(2)与硼元素性质最相似的元素的原子的最外层电子排布为_______,该原子核外充有电子的轨道共有____个。
(3)试写出天然硼砂与硫酸反应的化学方程式_______,制得的氮化硼有不同的结构,其中超硬、耐磨、耐高温的一种属于____晶体。制取氮化硼的反应必须在密闭的耐高温容器中进行:B2O3(s)+2NH3(g)![]() 2BN(s)+3H2O(g)+Q(Q<0)
2BN(s)+3H2O(g)+Q(Q<0)
(4)若反应在5L的密闭容器中进行,经2分钟反应炉内固体的质量减少60.0g,则用氨气来表示该反应在2分钟内的平均速率为_____,达到平衡后,增大反应容器体积,在平衡移动过程中,逆反应速率的变化状况为______。
(5)为提高生产效率,使反应速率加快的同时,化学平衡向多出产品的方向移动,可以采取的措施有_________,生产中对尾气的处理方法正确的是(填序号)_____。
A.直接排出参与大气循环 B.冷却分离所得气体可以循环使用
C.全部用来进行循环使用 D.冷却分离所得液体可作化工原料
查看答案和解析>>
科目: 来源: 题型:
【题目】PBAT(聚已二酸对苯二甲酸丁酯)可被微生物几乎完全降解,成为包装、医疗和农用薄膜等领域的新兴材料,它可由聚合物PBA和PBT共聚制得,一种合成路线如下:

已知: 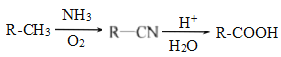
![]()
回答下列问题:
(1)G的官能团的名称为________。
(2)①的反应类型为___________;反应②所需的试剂和条件是___________。
(3)D的结构简式为___________;H的化学名称为___________。
(4)⑤的化学方程式为_______________________________________________。
(5)M与G互为同系物,M的相对分子质量比G大14;N是M的同分异构体,写出同时满足以下条件的N的结构简式:___________________(写两种,不考虑立体异构)。
Ⅰ、既能与FeCl3发生显色反应,又能发生水解反应和银镜反应;
Ⅱ、与NaOH溶液反应时,1mol N能消耗4molNaOH;
Ⅲ、核磁共振氢谱有五组峰,峰面积比为1:2:2:2:1。
(6)设计由丙烯为起始原料制备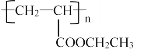 的单体的合成路线(其它试剂可任选)________________________________________________________________。
的单体的合成路线(其它试剂可任选)________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】K、Al、Si、Cu、Ni均为重要的合金材料,在工业生产、科技、国防领域有着广泛的用途,请回答下列问题:
(1)K元素处于元素同期表的_____区。
(2)下列状态的铝中,电离最外层一个电子所需能量最大的是______(填标号)。
A. [Ne]![]() B.[Ne]
B.[Ne]![]()
![]() C.[Ne]
C.[Ne] ![]()
![]() D. [Ne]
D. [Ne]![]()
![]()
![]()
3s 3s 3p 3s 3p 3s 3p 3p
(3)从核外电子排布角度解释高温下Cu2O比CuO更稳定的原因是_____________。
(4)一些化合物的熔点如下表所示:
化合物 | NaCl | KCl | SiO2 |
熔点/°C | 801 | 770 | 1723 |
解释表中化合物之间熔点差异的原因________________________________。
(5)NiSO4溶于氨水形成[Ni(NH3)6]SO4。
①N、O、S三种元素中电负性最大的是_______。
②写出一种与[Ni(NH3)6]SO4中的阴离子互为等电子体的分子的分子式_________。
③1mol[Ni(NH3)6]SO4中含有δ键的数目为___________。
④NH3的VSEPR模型为____;NH3、SO42-的中心原子的杂化类型分别为___、___。
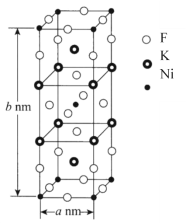
(6)K、Ni、F三种元素组成的一种晶体的长方体晶胞结构如图所示。若NA为阿伏加德罗常数的值,该晶体的密度ρ=______g·cm-3(用代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】右图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是( )

A. 铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生
B. 如果将锌片换成铁片,电路中的电流方向将改变
C. 其能量转化的形式主要是“化学能→电能→光能”
D. 如果将稀硫酸换成柠檬汁,LED灯将不会发光
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧硫酸氢钾复合盐(K2SO4KHSO42KHSO5)易分解,可用作漂白剂、NOx和SO2等的脱除剂。某研究小组制备过氧硫酸氢钾复合盐的流程如图所示。

已知:浓硫酸与H2O2反应,部分转化为过硫酸(化学式为H2SO5,是一种一元强酸)
(1)H2SO5中硫元素的化合价为+6价,其中过氧键的数目为________;工业上用过氧硫酸氢钾复合盐溶液脱除NO时,反应的离子方程式为___________________________。
(2)若反应物的量一定,在上述流程的“转化”步骤中需用冰水浴冷却,且缓慢加入浓硫酸,其目的是___________________________。
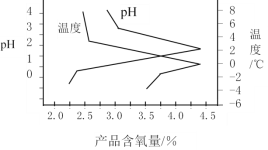
(3)“结晶”操作中,加入K2CO3即可获得过氧硫酸氢钾复合盐晶体,该过程的化学方程式为______________________________。过氧硫酸氢钾复合盐产率(以产品含氧量表示)随溶液pH和温度的变化关系如图所示,则该过程适宜的条件是_________________。
(4)产品中KHSO5含量的测定:取1.000g产品于锥形瓶中,用适量蒸馏水溶解,加入5mL5%的硫酸和5mL25%的KI溶液,再加入1mL淀粉溶液作指示剂,用0.2000mol·L-1硫代硫酸钠标准液滴定至终点,消耗标准液的体积为25.00mL。
已知:2KHSO5+4KI+H2SO4 = 2I2+3K2SO4+2H2O I2+2Na2S2O3 =Na2S4O6+2NaI
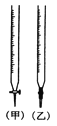
①用_____滴定管盛装标准浓度的硫代硫酸钠溶液(填“甲”或“乙”)。
②产品中KHSO5的质量分数为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。
Ⅰ. 某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照下表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液+1 mL H2O | 1 mL 0.1 mol·L-1FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+1 mL HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+1 mL NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(1)实验①和②的目的是___。同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是__________(写出一种即可)。
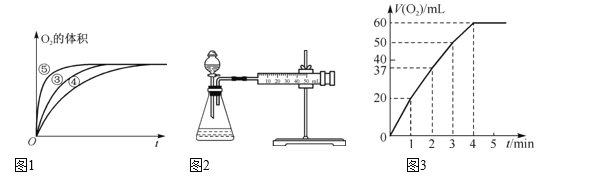
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如图1所示。分析该图能够得出的实验结论是____。
Ⅱ. MnO2对H2O2的分解有催化作用,某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将状态不同的0.1 g MnO2分别加入盛有50 mL等浓度的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2状态 | 触摸试管情况 | 观察结果 | 反应完成所需时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 4 min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30 min |
(1)写出大试管中发生反应的化学方程式:__,该反应是____反应(填“放热”或“吸热”)。
(2)实验结果表明,催化剂的催化效果与____有关。
(3)实验过程中放出气体的体积(标准状况)和时间的关系如图3所示。解释反应速率变化的原因:__,计算H2O2的初始物质的量浓度为____。(保留两位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com