
科目: 来源: 题型:
【题目】指出下列原子的杂化轨道类型及分子的结构式、空间构型。
(1)CO2分子中的C采取______杂化,分子的结构式为______,空间构型呈______;
(2)CH2O中的C采取______杂化,分子的结构式为______,空间构型呈______;
(3)H2S分子中的S采取______杂化,分子的结构式为______,空间构型呈______。
查看答案和解析>>
科目: 来源: 题型:
【题目】第ⅤA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含第ⅤA族元素的化合物在研究和生产中有许多重要用途。
(1)砷元素的基态原子价电子排布图为_____________;
(2)氮元素的单质除了N2外,还有N4,则N4中的N原子的轨道杂化方式为____________;
(3)对氨基苯甲醛与邻氨基苯甲醛相比,沸点较高的是_________(填空“前者”或“后者”),原因是________;
(4)王水溶解黄金的反应如下:Au+HNO3+4HCl=H[AuCl4]+NO+2H2O,产物中的H[AuCl4]是配合物,它的配位体是____________,Au元素提供_________;
(5)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是变通灯泡的100倍,而耗能只有其10%。推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。已知砷化镓的晶胞结构如图,晶胞参数α=565pm。(黑球:Ga, 白球:As)
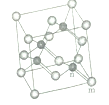
砷化镓的化学式___________,镓原子的配位数为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醇和乙酸是生活中常见的有机物。
(1)如图所示为___(填“乙醇”或“乙酸”)的球棍模型。
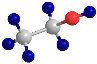
(2)乙醇中所含有的官能团的名称为___,乙酸中所含有的官能团的名称为___。
(3)写出实验室由乙醇制取乙醛的化学反应方程式___。
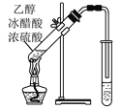
(4)写出如图所示装置中乙醇和乙酸反应的化学方程式:___。该反应的类型为___反应,右侧小试管中应装有___溶液。
查看答案和解析>>
科目: 来源: 题型:
【题目】乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O,相对分子质量为288}易溶于水,是一种很好的补铁剂,可由乳酸[CH3 CH(OH)COOH]与FeCO3反应制得。
I.碳酸亚铁的制备(装置如下图所示)

(1)仪器B的名称是__________________;实验操作如下:打开kl、k2,加入适量稀硫酸,关闭kl,使反应进行一段时间,其目的是__________________。
(2)接下来要使仪器C中的制备反应发生,需要进行的操作是____________,该反应产生一种常见气体,写出反应的离子方程式_________________________。
(3)仪器C中混合物经过滤、洗涤得到FeCO3沉淀,检验其是否洗净的方法是__________。
Ⅱ.乳酸亚铁的制备及铁元素含量测定
(4)向纯净FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应,经过滤,在____________的条件下,经低温蒸发等操作后,获得乳酸亚铁晶体。
(5)两位同学分别用不同的方案进行铁元素含量测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度。在操作均正确的前提下,所得纯度总是大于l00%,其原因可能是_________________________。
②乙同学经查阅资料后改用碘量法测定铁元素的含量计算样品纯度。称取3.000 g样品,灼烧完全灰化,加足量盐酸溶解,取所有可溶物配成l00mL溶液。吸取25.00 rnL该溶液加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0. 100 mol·L-1硫代硫酸钠溶液滴定(已知:I2+2S2O32-=S4O62-+2I-),当溶液_____________________,即为滴定终点;平行滴定3次,硫代硫酸钠溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)2017年中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
已知:H2(g)+1/2O2(g)=H2O(l) ΔH1 = -aKJ/mol
C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH2= -bKJ/mol
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式_________________________________。
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
甲:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
乙:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
①CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
②提高CO2转化为CH3OH平衡转化率的措施有___________(填写两项)。
③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)。
温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) | 综合选项 |
543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
553 | Cu/ZnO纳米片材料 | 12.0 | 70.6 | D |
由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________(填字母符号)。
(3)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
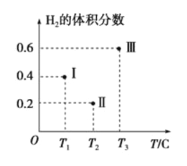
①0~5min时间内容器Ⅱ中用CH3OH表示的化学反应速率为_________________。
②三个容器中一定达到平衡状态的是容器________(填写容器代号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】2017年冬季,我国北方大部分地区出现严重雾霾天气,引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等。城市雾霾中还含有铜等重金属元素。
(1)N元素原子核外电子云的形状有___________种;基态铜原子的价电子排布式为___________,金属铜的晶体中,铜原子的堆积方式为___________。
(2)N和O中第一电离能较小的元素是___________;SO42-的空间构型___________。
(3)NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为___________。
(4)测定大气中PM2.5浓度的方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,晶胞边长为540pm,则该晶体的密度___________g/cm3(只列式不计算)(1pm=10-10cm)
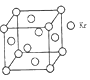
查看答案和解析>>
科目: 来源: 题型:
【题目】甲烷、乙烯是常见的化工原料。
(1)甲烷的分子构型为___(填“平面正方形”或“正四面体形”)。
(2)写出甲烷和氯气按分子数之比为1∶1发生反应的化学方程式:___。该反应的类型为___反应。
(3)乙烯中含有官能团的名称为___。
(4)写出乙烯与氢气发生反应的化学方程式:___。该反应的类型为___反应。
(5)下列试剂不能鉴别甲烷和乙烯的是___(填字母)。
a.溴水
b.酸性高锰酸钾溶液
c.NaOH溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物E是重要的医药中间体,B中碳原子数目是A中的3倍。以A和B为原料合成该有机物的路线如下:
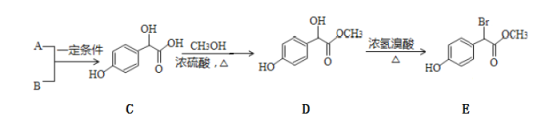
(1)已知A+B→C为加成反应,则A的结构简式为___________,B的化学名称为 _______,E中含有的官能团有_______________________(填名称)。
(2)1mol C在一定条件下与浓溴水反应,最多消耗溴的物质的量为______mol。C生成D的反应类型为______________。
(3)2分子C脱水可以生成F,核磁共振氢谱显示F分子中含有4种氢原子,其结构中有3个六元环,则F分子的结构简式为________________。
(4)E有多种同分异构体,其中苯环上只有2个对位取代基,含有-COOH且能使FeCl3溶液显紫色的结构有_______________(不考虑立体异构)种。
(5)根据已有知识并结合信息 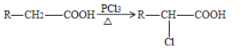 ,写出以CH3COOH为原料制备A的合成路线图:___________________________________。(无机试剂任选,注明反应条件)。
,写出以CH3COOH为原料制备A的合成路线图:___________________________________。(无机试剂任选,注明反应条件)。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,青蒿素是一种无色针状晶体,易溶于有机溶剂,难溶于水,熔点约为156.5℃,易受湿、热的影响而分解。某实验小组对青蒿素的提取和组成进行了探究。
Ⅰ.提取流程:
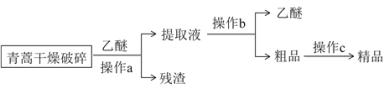
⑴ “破碎”的目的是_______________________________________。
⑵ 操作a和操作b的名称分别是_________、___________。
⑶ 操作a用到的玻璃仪器有玻璃棒、_____________________。
⑷ 操作a所用青蒿必须干燥且不宜加热,原因是_______________________________。
Ⅱ.燃烧法测定最简式:
实验室用下图所示装置测定青蒿素(烃的含氧衍生物)中氧元素的质量分数。
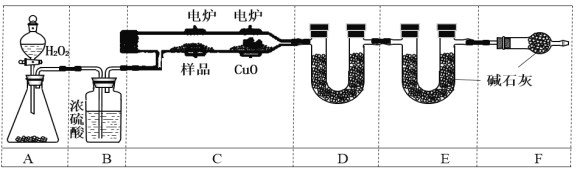
⑸ 实验前至少称量_________个质量数据。
⑹ 装置D中所盛固体可以是____(用对应符号填空);(a.生石灰 b.CaCl2 c.CuSO4 d.碱石灰)
F的作用是_______________________________________。
⑺ A中固体分别用MnO2、KMnO4时产生等量O2,消耗H2O2的物质的量之比为______。(生成的O2全部放出,与KMnO4反应的H2O2经过酸化)
⑻ 燃烧m g青蒿素,图中D、E的质量分别增重a g、b g,则青蒿素中氧元素的质量分数可表示为_________________(只写计算式,用含有m、a、b的符号来表示,不化简)。
查看答案和解析>>
科目: 来源: 题型:
【题目】锶有“金属味精”之称。以天青石(主要含有SrSO4和少量CaCO3、MgO杂质)生产氢氧化锶的工艺如下:

已知氢氧化锶在水中的溶解度:
温度(℃) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
溶解度(g/100mL) | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
(1)隔绝空气焙烧时SrSO4只被还原成SrS,化学方程式为____。
(2)“除杂”方法:将溶液升温至95℃,加NaOH溶液调节pH为12。
①95℃时水的离子积KW=1.0×10-12,Ksp[Mg(OH)2]=1.2×10-10,则溶液中c(Mg2+)=____。
②若pH过大,将导致氢氧化锶的产率降低,请解释原因____。
(3)“趁热过滤”的目的是____,“滤渣”的主要成分为___。
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为____、过滤、洗涤、干燥。
(5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,吸收时的氧化产物为___(填化学式);再用石墨电极电解吸收液,电解后可在“脱硫”中循环利用的物质是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com