
科目: 来源: 题型:
【题目】现有A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大。A能分别与B、C、D三种元素形成电子数相同的分子,且B的最外层电子数是次外层电子数的2倍。E的阳离子、D的阴离子均与氖原子的电子层结构相同,且E的单质与D的单质反应能生成E2D和E2D2两种化合物。F所在主族序数与所在周期序数之差为4。(答题时,请用具体的化学用语表示)
(1)元素B在周期表中的位置__________周期________族;C元素的原子结构示意图_________________。
(2)写出由E、F两种元素形成的离子化合物的电子式________________,C2A4的结构式为:_______________,用电子式表示E2D的形成过程:_____________________。
(3)C、D、E形成的简单离子的半径由大到小的顺序为:_____________________。(用离子符号表示)
(4)E的最高价氧化物对应的水化物与F的最高价氧化物对应的水化物之间发生的化学反应方程式为:______________________________________________________________。
(5)向KI溶液中通入适量的F单质后,再滴加一定量的CCl4,振荡静置后的现象为_____________________________________,继续通入F单质并充分振荡,混合溶液逐渐褪为无色,若1mol还原剂转移10NA电子,上述反应的化学方程式为:___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】山梨酸是应用广泛的食品防腐剂,其分子结构如图所示。下列说法错误的是
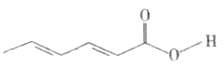
A.山梨酸的分子式为C6H8O2
B.1 mol山梨酸最多可与2 mol Br2发生加成反应
C.山梨酸既能使稀KMnO4酸性溶液褪色,也能与醇发生置换反应
D.山梨酸分子中所有碳原子可能共平面
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①A是石油裂解气的主要成份,A的产量可以衡量国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH ③已知乳酸E的结构简式为
2CH3COOH ③已知乳酸E的结构简式为![]() ,现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
,现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
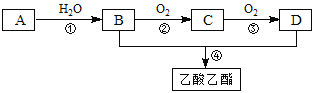
回答下列问题:
(1)A为______________(填结构简式) C为________________(填名称)
(2)E分子中所含有的官能团是_______________、________________(填名称)
(3)写出第②和④步反应的化学方程式:
②的方程式______________________________________________;反应类型_________
④的方程式______________________________________________;反应类型__________
(4)写出E和足量钠反应的方程式__________________________________________。
(5)写出两个E分子在一定条件下反应生成六元环状酯的化学方程式________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】NaNO2是一种食品添加剂,它能致癌。酸性 KMnO4溶液与 NaNO2。的反应方程式是MnO4-+NO2-+□→Mn2++NO3-+H2O。下列叙述中正确的是( )
A. 该反应中 NO2-被还原 B. 反应过程中溶液的pH 减小
C. 生成1 mol NaNO3需消耗 0.4mol KMnO4 D. □中的粒子是 OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】NO2和N2O4之间发生反应:N2O4![]() 2NO2,一定温度下,体积为2L的密闭容器中,各物质的物质的量随时间变化的关系如图所示。请回答下列问题:
2NO2,一定温度下,体积为2L的密闭容器中,各物质的物质的量随时间变化的关系如图所示。请回答下列问题:
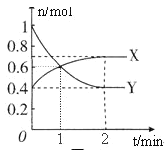
(1)曲线____________(填“X”或“Y”)表示NO2的物质的量随时间的变化曲线。在0到1min中内用X表示该反应的速率是________________,该反应达最大限度时Y的转化率_______。
(2)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中 v(NO2)=0.3 mol·L-1·min-1,乙中y(N2O4)=0.2 mol·L-1·min-1,则__________中反应更快。
(3)下列描述能表示反应达平衡状态的是______________________。
A.容器中X与Y的物质的量相等
B.容器内气体的颜色不再改变
C.2v(X)=v(Y)
D.容器内气体的平均相对分子质量不再改变
E.容器内气体的密度不再发生变化
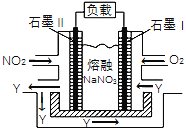
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如右图,该电池在使用过程中石墨Ⅱ电极上生成氧化物Y(N2O5),则石墨I电极是______________(填“正极”或“负极”),石墨Ⅱ的电极反应式为_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】溴、碘主要存在于海水中,有“海洋元素”的美称。海水中的碘主要富集在海带中,我国海带产量居世界第一位,除供食用外,大量用于制碘。提取碘的途径如下图所示,下列有关叙述正确的是
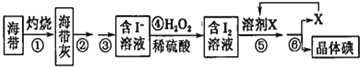
A. 此装置进行操作①
此装置进行操作①
B.②③操作中所用到的玻璃仪器有:玻璃棒、烧杯、分液漏斗
C.④中当1molH2O2氧化I-时,转移电子数为2NA
D.溶剂X可选用酒精或苯
查看答案和解析>>
科目: 来源: 题型:
【题目】元素铬(Cr)在自然界主要以+3价和+6价存在。回答下列问题:
(1)+6价的Cr能引起细胞变异而对人体不利,可用Na2SO3将Cr2O72-还原为Cr3+,反应的离子方程式为____________________。
(2)利用铬铁矿(FeO·Cr2O3)冶炼制取金属铬的工艺流程如图所示:
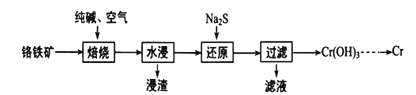
①为加快焙烧速率和提高原料的利用率,可采取的措施是_________(写一条)。
②“水浸”后,要获得浸出液的操作是_______。浸出液的主要成分为Na2CrO4,向“滤液”中加入酸化的氯化钡溶液有白色沉淀生成,则“还原”操作中发生反应的离子方程式为______。
③加热Cr(OH)3可得到Cr2O3。从工业成本角度考虑,用Cr2O3制取金属Cr的冶炼方法是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设阿伏加德罗常数的值为NA。下列说法正确的是( )
A. 标准状况下,2.24 L水中所含电子总数为NA
B. 将27 g Al加入到1 mol/L的NaOH溶液中反应,转移的电子数为3NA
C. 100 mL 2 mol/L的Na2CO3溶液中含有的离子总数为0.6NA
D. 7.8 g Na2O2固体中含有0.3NA个离子
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,氯化法是合成硫酰氯(SO2Cl2)的常用方法。实验室合成硫酰氯的实验装置如下图所示(部分夹持装置未画出):

已知:① SO2(g) + Cl2(g)=SO2Cl2(l) ΔH=-97.3 kJ/mol。
② 硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”。
③ 100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
回答下列问题:
(1) 装置A中发生反应的离子方程式为___________。
(2) 装置B的作用为_______________________________,若缺少装置C,装置D中SO2与Cl2还可能发生反应的化学方程式为________________________。
(3) 仪器F的名称为_________________,E中冷凝水的入口是___________(填“a”或“b”),F的作用为_______________________________________________。
(4) 当装置A中排出氯气1.12 L(已折算成标准状况)时,最终得到5.4 g纯净的硫酰氯,则硫酰氯的产率为____________。为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有________(填序号)。
① 先通冷凝水,再通气② 控制气流速率,宜慢不宜快
③ 若三颈烧瓶发烫,可适当降温④ 加热三颈烧瓶
(5) 氯磺酸(ClSO3H)加热分解,也能制得硫酰氯2ClSO3H=SO2Cl2 + H2SO4,分离产物的方法是_____
A.重结晶B.过滤 C.蒸馏D.萃取
(6) 长期存放的硫酰氯会发黄,其原因可能为_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,将2 mol SO2和1 mol O2充入一定容积的密闭容器中,在催化剂作用下发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-197kJ/mol,下列说法中正确的是
2SO3(g) ΔH=-197kJ/mol,下列说法中正确的是
A.为提高SO2转化率,可以再加入SO2B.平衡时放出197kJ热量
C.平衡时再充入O2,则v正增大,v逆减小D.平衡时SO2和SO3共2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com