
科目: 来源: 题型:
【题目】有机物M 的结构简式如下:下列有关M 叙述不正确的是( )
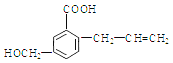
A. M的分子式为C11H12O3
B. 能使溴的四氯化碳溶液褪色
C. 一定条件下,M能生成高分子化合物
D. 能发生加成反应不能发生取代反应
【答案】D
【解析】
试题A.根据物质的结构简式可知M的分子式是C11H12O3,正确; B.该物质的分子中含有碳碳双键,因此能使溴的四氯化碳溶液褪色,正确;C. 该物质的分子中含有碳碳双键,在一定条件下发生加聚反应形成高聚物,正确;D. 化合物M含有碳碳双键,因此能发生加成反应,含有醇羟基、羧基,因此可以发生取代反应,错误。
考点:考查有机物的结构与性质的关系的知识。
【题型】单选题
【结束】
22
【题目】下列有关金属腐蚀与防护的说法不正确的是( )
A. 钢铁发生电化学腐蚀时,若表面水膜呈中性,则正极发生的反应为:2H2O+O2+4e一= 4OH一
B. 在潮湿的空气中,黄铜(铜锌合金)制品比纯铜制品更易产生铜绿
C. 金属制品在海水中比淡水中更容易发生腐蚀
D. 从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程
【答案】B
【解析】A、钢铁发生电化学腐蚀时,若表面水膜呈中性发生吸氧腐蚀,则正极发生的反应为:2H2O+O2+4e一=4OH一,A正确;B、在潮湿的空气中易发生电化学腐蚀,锌的金属性强于铜,因此黄铜(铜锌合金)制品比纯铜制品更不易产生铜绿,B错误;C、海水中含电解质浓度大,淡水中含电解质浓度小,故金属制品在海水中比淡水中更容易发生腐蚀,C正确;D、从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程,D正确;答案选B。
【题型】单选题
【结束】
23
【题目】下列说法不正确的是
A. 麦芽糖及其水解产物均能发生银镜反应
B. 用溴水即可鉴别苯酚溶液,2,4-已二烯和甲苯
C. 在酸性条件下,![]() 的水解产物是
的水解产物是![]() 和
和![]()
D. 用甘氨酸![]() 和丙氨酸
和丙氨酸![]() 缩合最多可形成4种二肽
缩合最多可形成4种二肽
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )
A.单位时间生成nmol的A2同时生成nmol的AB
B.容器内的压强不随时间变化
C.单位时间生成2nmol的AB同时生成nmol的B2
D.单位时间生成nmol的A2同时生成nmol的B2
查看答案和解析>>
科目: 来源: 题型:
【题目】在不同条件下分别测得反应2SO2+O2![]() 2SO3的化学反应速率,其中表示该反应进行得最快的是( )
2SO3的化学反应速率,其中表示该反应进行得最快的是( )
A.v(SO2)=4mol/(L·min)B.v(O2)=3mol/(L·min)
C.v(SO2)=0.1mol/(L·s)D.v(O2)=0.1mol/(L·s)
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组选用以下装置进行实验设计和探究(图中a、b、c均为止水夹):
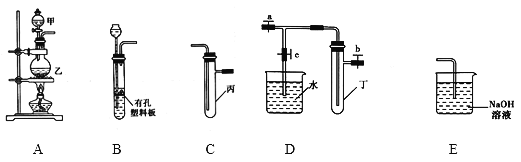
(1)在进行气体制备时,应先检验装置的气密性。将A装置中导管末端密封后,在分液漏斗甲内装一定量的蒸馏水,然后______,则证明A装置的气密性良好。
(2)利用E装置能吸收的气体有______(任写两种即可)。
(3)用锌粒和稀硫酸制备H2时应选用装置___作为发生装置(填所选装置的字母序号),实验时先在稀硫酸中加入少量硫酸铜晶体可使反应速率加快,原因是__。
(4)某同学将A、C、E装置连接后设计实验比较Cl-和S2-的还原性强弱。
①A中玻璃仪器甲的名称为____,A装置中发生反应的离子方程式为____。
②C中说明Cl-和S2-的还原性强弱的实验现象_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】VA族的氮、磷、砷(As)等元素的化合物在科研和生产中有许多重要用途,请回答下列问题。
(1)砷的基态原子的电子排布式为___________________。
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,N、P、As原子的第一电离能由大到小的顺序为______________。
(3)NH3的沸点比PH3高,原因是___________;PO43-离子的立体构型为___________。
(4)AsH3是无色稍有大蒜气味的气体,在AsH3中As原子的杂化轨道类型为______________。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3 酸性强的原因_____________________。
(6)磷的一种单质白磷(P4)属于分子晶体,其晶胞结构如下图。已知最近两个白磷分子间的距离为 a pm(1pm=10-12m),阿伏加德罗常数的值为NA,则该晶体的密度为__________________g/cm3(只要求列算式,不必计算)。

查看答案和解析>>
科目: 来源: 题型:
【题目】已知乙酸中的氧都是18O,则乙酸和乙醇在一定条件下反应,经过足够长的时间后,体系中含有18O的物质是
A. 只有乙酸
B. 只有乙酸乙酯
C. 乙酸、乙酸乙酯、水
D. 乙酸乙酯、乙醇、水
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题:
(1)已知室温下CO的燃烧热为283kJ/mo1,则CO的燃烧热的热化学方程式为____。
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH=-116kJ/mo1
CH3OH(g) ΔH=-116kJ/mo1
如图表示CO的平衡转化率(α)随温度和压强变化的示意图。
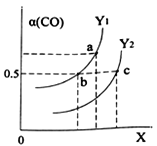
X表示的是_____,Y1___Y2(填“<”、“=”、“>”)。
(3)合成甲醇的反应原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
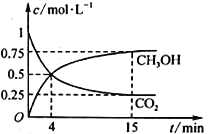
①反应进行到4min时,v(正)___v(逆)(填“>”“<”或“=”)。0~4min,CO2的平均反应速率v(CO2)=_____mol·L1·min1。
②该温度下平衡常数为____。
③下列能说明该反应已达到平衡状态的是____。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1∶3∶1∶1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
查看答案和解析>>
科目: 来源: 题型:
【题目】国际奥委会公布的违禁药物有138种,其中某种兴奋剂分子结构如图,关于它的说法正确的是( )

A. 该物质属于芳香烃
B. 该分子中所有碳原子共面
C. 1mol该物质与氢氧化钠溶液完全反应,最多消耗2molNaOH
D. 该物质的化学式为C15H24ClNO2
查看答案和解析>>
科目: 来源: 题型:
【题目】共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量。如H-H键的键能是436kJ/mol,H—Cl键的键能是431kJ/mol,Cl—Cl键的键能是247 kJ /mol,H2和Cl2反应生成1molHCl放出的热量是( )
A.431kJB.179kJC.89.5kJD.以上说法都不对
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D均为中学化学常见物质,且含有一种相同的元素,它们之间有如下转化关系,其中A是单质。
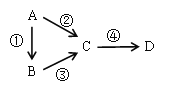
(1)若A是一种淡黄色固体,B是气态氢化物,C、D为气态氧化物,且C是形成酸雨的主要物质。请写出C与B反应的化学方程式_________________________________。
(2)若B是气态氢化物,C、D为气态氧化物,且C、D是形成光化学烟雾的一个重要原因。请写出反应③的化学方程式____________________________________。实验室中检验气体B存在用的试剂或用品为________________。
(3)若B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现。据此判断A元素在周期表中的位置是_________________。请写出②的离子方程式_________________________________。
(4)若C是一种淡黄色固体,常用于吸吸面具中的供氧剂,D是一种强碱。写出反应④的离子方程式_________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com