
科目: 来源: 题型:
【题目】在溶液中加入过量Na2O2后仍能大量共存的是
A.NH![]() 、Ba2+、Cl-、NO
、Ba2+、Cl-、NO![]() B.K+、SiO
B.K+、SiO![]() 、AlO
、AlO![]() 、SO
、SO![]()
C.Fe2+、Mg2+、SCN-、Cl-D.Na+、SO![]() 、I-、HCO
、I-、HCO![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,体积均为20 mL、浓度均为0.1mol/L的两种酸HX、HY分别与0.1mol/L的NaOH溶液反应,所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是( )
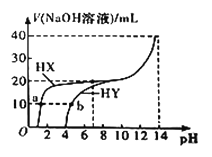
A. 加入10 mL NaOH溶液时,a点c(X)<b点c(Y)
B. HY中加NaOH溶液至pH=7时,所得溶液中c(Y)=c(Na+)=c(OH)=c(H+)
C. b点溶液中,c(Y)+2c(OH)=c(HY)+2c(H+)
D. 25℃时,HX为强酸,HY为弱酸且Ka=108
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验设计及其对应的离子方程式均正确的是
A.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO![]() + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
B.Na2O2与H2O反应制备O2 :Na2O2 + H2O = 2Na+ + 2OH- + O2↑
C.将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO-
D.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ = Cu2+ + 2Fe2+
查看答案和解析>>
科目: 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,消毒时本身被还原成氯离子,也常用来漂白织物等,其一种生产工艺如下:
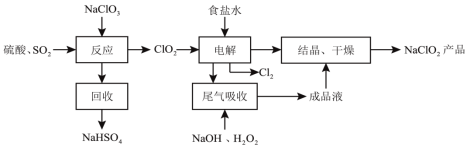
回答下列问题:
(1)NaClO2中Cl的化合价为__________。
(2)写出“反应”步骤中生成ClO2的离子方程式________,该过程体现了SO2的______________( 选填:a 氧化性、b还原性、c漂白性、d酸性氧化物的通性)
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去SO![]() 和Mg2+要加入的试剂分别为__________、__________。“电解”过程的氧化产物是Cl2,则还原产物是_______。
和Mg2+要加入的试剂分别为__________、__________。“电解”过程的氧化产物是Cl2,则还原产物是_______。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2,此吸收反应的化学方程式为__________,实验室进行结晶操作使用的仪器有铁架台(带铁圈)、酒精灯、玻璃棒、坩埚钳和__________。
(5)消毒能力可用单位质量消毒剂得电子多少来衡量。NaClO2与Cl2消毒能力比为___________。(不必化简)。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 10gNH3含有4NA个电子
B. 0.1mol铁和0.1mol铜分别与0.1 mol氯气完全反应,转移的电子数均为0.2NA
C. 标准状况下,22.4 L H2O中分子数为NA 个
D. 1L0.1mol·L-1Na2CO3溶液中含有0.1NA个CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】以电解法生产金属锰产生的阳极泥中,其锰含量高达40%~50%,主要成分为MnO2的水合物,且含有显著量的Pb2+、Sn2+等重金属杂质.本工艺采用的木屑富含的纤维素在较浓硫酸的作用下膨胀、水解生成还原糖,酸性条件下,可与二氧化锰反应生成可溶性的硫酸锰。

(1)工业上电解硫酸锰的水溶液生产金属锰,阳极的电极反应式为_____________。
(2)写出木屑水解反应的化学方程式:___________
配平浸出步骤反应方程式C6H12O6+MnO2+H2SO4→MnSO4+CO2+H2O_________________
(3)若取消除酸操作步骤,将会产生气体_____________(填化学式)而污染环境;
(4)本工艺的一种副产品是重要的农业生产资料,写出其化学式____;
(5)取一定量的阳极泥进行实验分析,得到如图象。硫酸的最合适用量为________mL,若再增加硫酸的用量,将会导致____________(填化学式)的消耗量增大。

(6)某阳极泥中MnO2(相对分子质量为87)的质量分数为50.0%,将174g该阳极泥与320g36.5%的浓盐酸混合加热,则产生的氯气在标准状况下应少于_________L。(假设阳极泥中的其它成分不参与反应)
查看答案和解析>>
科目: 来源: 题型:
【题目】研究生铁的锈蚀,下列分析不正确的是
序号 | ① | ② | ③ |
实验 |
|
|
|
现象 | 8小时未观察 到明显锈蚀 | 8小时未观察 到明显锈蚀 | 1小时观察 到明显锈蚀 |
A. ①中,NaCl溶液中溶解的O2不足以使生铁片明显锈蚀
B. ②中,生铁片未明显锈蚀的原因之一是缺少H2O
C. ③中正极反应:O2+4e+ 2H2O ==4OH
D. 对比①②③,说明苯能隔绝O2
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:
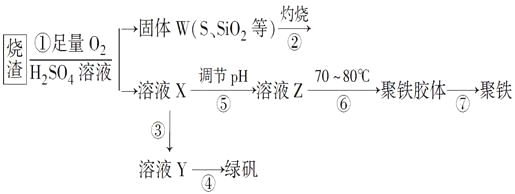
(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是________。
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为:________。
(3)过程③中,需加入的物质是________。
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有___________。
(5)过程⑤调节pH可选用下列试剂中的________(填选项序号)。
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70~80℃,目的是___________。
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.800 g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥、称量,得固体质量为3.495 g。若该聚铁主要成分为[Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为________。(假设杂质中不含铁元素和硫元素)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知有A、B、C、D、E五种短周期的主族元素,它们的原子序数依次递增,A是所有元素中原子半径最小的元素,B、C组成的某一种化合物能引起温室效应。常温下,金属D单质投入水中能与水剧烈反应。常温下E单质是常见的气体。请按要求回答下列几个问题:
(1)B、D的元素名称分别为:________、________。
(2)E在周期表中的位置为:________。
(3)C离子的结构示意图为:________。
(4)B、C、D三种元素的原子半径从大到小的顺序为________(用元素符号表示)。
(5)B、E的最高价氧化物对应水化物的酸性从强到弱的顺序为:________(用对应的化学式表示)。
(6)写出C、D两种元素组成的阴、阳离子个数比为1:2且只含离子键的化合物的电子式:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,体积和pH都相同的NaOH溶液与CH3COONa溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
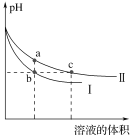
A. c点的溶液中c(OH)+c(CH3COOH)=c(H+)
B. a、b两点溶液的导电性:a>b
C. b、c两点溶液中水的电离程度:b=c
D. 用相同浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸的体积:Vb=Vc
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com