
科目: 来源: 题型:
【题目】Ⅰ.高效净水剂聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6﹣n]m,该物质广泛应用于日常生活用水和工业废水的处理。该物质可溶于盐酸产生相应的金属阳离子。为检测PAFC中铝和铁元素的含量,采用如图所示流程进行:
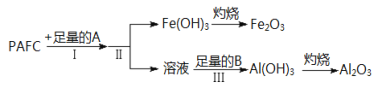
回答下列问题:
⑴PAFC中铁元素的化合价为_____,如何检验该元素的存在___________________
⑵步骤I中的试剂A是_______________(从“氢氧化钠溶液”、“氨水”中选择)步骤Ⅲ中的试剂B是_____________,离子方程式是__________
⑶步骤Ⅱ的操作是______________________
Ⅱ. ⑴甲同学用氢氧化钠溶液和氯化亚铁溶液制备氢氧化亚铁沉淀,该同学将氢氧化钠溶液加入氯化亚铁溶液中,观察到的现象是____________,反应过程中发生反应的化学方程式是_________。乙同学通过如下改进制备氢氧化亚铁:
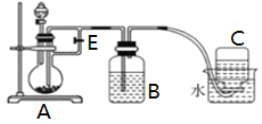
实验提供的试剂:铁屑、3mol/L硫酸溶液、NaOH溶液。请回答下列问题:
⑵①分液漏斗中盛装的试剂是______________溶液 (从“H2SO4”和“NaOH”中选择)。
②实验开始时应将止水夹E___________ (从“打开”和“关闭”中选择)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某合金X由常见的两种元素组成。为探究该合金X的元素组成和性质,设计并进行如下实验:
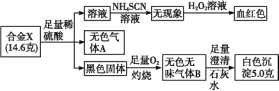
根据上述信息,回答下列问题:
(1)合金X的化学式为________。
(2)用离子方程式解释溶液中滴加H2O2后呈红色的原因:_______
(3)写出336 mL(标准状况)气体B通入100 mL 0.2 mol/L 的NaOH溶液中的化学反应方程式:_______
查看答案和解析>>
科目: 来源: 题型:
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务,回答有关问题:
(1)在一定条件下,2H2O==2H2↑+O2↑,下图能正确表示该反应中能量变化的是________(用A、B表示)。

从断键和成键的角度分析上述反应中能量的变化。化学键的键能如下表:则生成1mol水热量变化为________kJ。
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
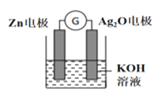
(2)在生产和生活中经常遇到化学能与电能的相互转化,银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其工作示意如图所示。在装置中Ag2O作_______极(填正或负)溶液中的K+向_____电极移动(填“Zn”或“Ag2O”);Ag2O电极发生______(还原或氧化反应),电极反应式为_____________________。
(3)一定温度下,将3molA气体和1molB气体通入一容积固定为1L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为_______;x为_________;此时反应物B的转化率为_________。若反应经2min达到平衡,平衡时C的浓度_____0.8mol/L(填“大于,小于或等于”)。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为_______;x为_________;此时反应物B的转化率为_________。若反应经2min达到平衡,平衡时C的浓度_____0.8mol/L(填“大于,小于或等于”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】选做(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据)。根据下图回答下列问题:
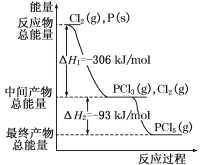
(a)P和Cl2反应生成PCl3的热化学方程式是______________________________ ;
(b)P和Cl2分两步反应生成1 mol PCl5的ΔH3=____________________,P和Cl2一步反应生成1 mol PCl5的ΔH4____________ΔH3(填“大于”.“小于”.或“等于”)。
(2)在微生物作用的条件下,NH经过两步反应被氧化成NO。这两步的能量变化示意图如下:

(a)第二步反应是________反应(选填“放热”或“吸热”),判断依据是__________ 。
(b)1molNH4+(aq)全部氧化成NO2-(aq)的热化学方程式是_____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物F是一种用途广泛的香料,可用烃A与有机物E为原料,按照如下流程进行合成。已知A在标准状况下的密度为1.25 g·L-1。
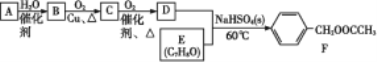
回答下列问题:
(1)有机物F中含有的官能团名称为____。
(2)A生成B的反应类型为________。
(3)写出流程中B生成C的化学方程式_______。
(4)下列说法正确的是____。
A 流程图中有机物B转化为C,Cu参与了化学反应,但反应前后的质量保持不变
B 有机物C不可能使溴水褪色
C 有机物D、E生成F的反应为酯化反应,本质上是取代反应
D 合成过程中原子的理论利用率为100%的反应只有一个
查看答案和解析>>
科目: 来源: 题型:
【题目】F(4-苯并呋喃乙酸)是合成神经保护剂依那朵林的中间体,某种合成路线如下:
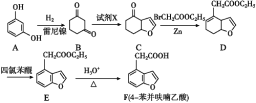
(1)化合物F中的含氧官能团为____和_______(填官能团的名称)。
(2)试剂X分子式为C2H3OCl且分子中既无甲基也无环状结构,则X的结构简式为_______;由E→F的反应类型为______。并写出该反应方程式:______
(3)写出同时满足下列条件的E的一种同分异构体的结构简式:______
Ⅰ.能发生银镜反应
Ⅱ.分子中含有1个苯环且有3种不同化学环境的氢
(4)请写出以![]() 和BrCH2COOC2H5为原料制备
和BrCH2COOC2H5为原料制备![]() 的合成路线流程图(无机试剂可任选)合成路线流程图示例如下:______
的合成路线流程图(无机试剂可任选)合成路线流程图示例如下:______
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目: 来源: 题型:
【题目】阿司匹林(乙酰水杨酸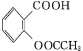 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的主要反应为
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的主要反应为
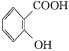 +(CH3CO)2O
+(CH3CO)2O![]()
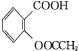 +CH3COOH
+CH3COOH
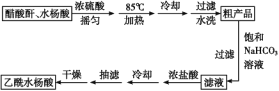
制备基本操作流程如下:
主要试剂和产品的物理常数:
名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
水杨酸 | 138 | 158(熔点) | 微溶 |
醋酸酐 | 102 | 139.4(沸点) | 反应 |
乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
请根据以上信息回答下列问题:
(1)合成过程中最合适的加热方法是__________。
(2)提纯粗产品时加入饱和NaHCO3溶液至没有CO2产生为止,再过滤,则加饱和NaHCO3溶液的目的是______
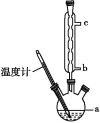
(3)另一种改进的提纯方法,称为重结晶提纯法。改进的提纯方法中加热回流的装置如图所示,仪器a的名称是____,冷凝管中冷凝水的进入口是____(填“b”或“c”),使用温度计的目的是_________
(4)检验产品中是否含有水杨酸的化学方法是_________
(5)该学习小组在实验中原料用量:2.76 g水杨酸、7.5 mL醋酸酐(ρ=1.08 g/cm3),最终称量产品m=2.92 g,则所得乙酰水杨酸的产率为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨气具有还原性,能够被氧化铜氧化,用如图中的装置可以实现该反应。

已知:氨可以与灼热的氧化铜反应得到氮气和金属铜。回答下列问题:
(1)B中加入的干燥剂是____(填序号)。
①浓硫酸 ②无水氯化钙 ③碱石灰
(2)能证明氨与氧化铜反应的现象是C中________。
(3)D中有无色液体生成。设计实验检验D中无色液体的成分:__________
查看答案和解析>>
科目: 来源: 题型:
【题目】(9分) 观察下列几个装置示意图,有关叙述正确的是
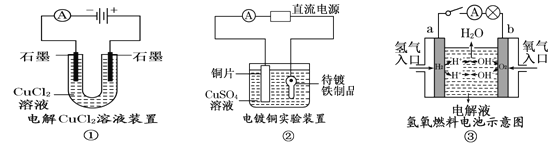
(1)在①图中,发生反应的化学方程式为: 。
(2)在②图中,待镀铁制品应与电源 极相连,电极反应式为: 。
(3)在③图中,外电路电子由 极流向 极,若电解液为KOH溶液,则b极的反应式为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】在2 L的密闭容器内,800℃时反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=___________________________。已知:K300℃>K350℃,则该反应是______热反应。
(2)下图表示NO2变化的曲线是____。用O2表示从0~2 s内该反应的平均速率v=_________。

(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com