
科目: 来源: 题型:
【题目】![]() 是一种重要的化工原料,是非常重要的有机反应的中间体,具有酸性。根据如下转化,回答相关问题:
是一种重要的化工原料,是非常重要的有机反应的中间体,具有酸性。根据如下转化,回答相关问题:
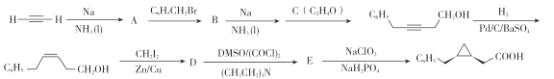
已知:
①亚甲基卡宾:CH2与双键加成得环丙烷类化合物,如:CH2+ ![]() →
→![]()
②HC≡C Na +CH3Br→HC≡CCH3 + NaBr
(1)写出A 的官能团的名称:________________。
(2)写出C的结构简式 :___________________。
(3)下列有关说法不正确的是___________
A.C与乙醛是同分异构体
B.A→B和D→E的反应类型相同
C. ![]() 含有两个手性碳原子
含有两个手性碳原子
D. 聚乙炔是一种重复结构单元为—CH=CH—的聚合物材料,可用于制备太阳能电池、半导体材料和电活性聚合物等
(4) 写出 A→B 的反应方程式:___________________。
(5)写出符合下列条件的![]() 的同分异构体:________ 。(不考虑立体异构和对映异构)
的同分异构体:________ 。(不考虑立体异构和对映异构)
①只有一个苯环,无其他环
②苯环上有四个取代基,且苯环上的一取代物只有1种
③有3个甲基
④该同分异构体的水解产物之一能发生银镜反应
(6)以苯和乙炔为基本原料合成![]() 用流程图表示,其他无机试剂任选):_______________________。
用流程图表示,其他无机试剂任选):_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸在水中电离方程式可表示为:CH3COOH![]() CH3COO—+H+ ΔH>0,下列操作能使H+ 浓度增大的是 ( )
CH3COO—+H+ ΔH>0,下列操作能使H+ 浓度增大的是 ( )
A. 加入少量NaOH固体 B. 小心加热升温10oC C. 加入锌粉 D. 加入固体CH3COONa
查看答案和解析>>
科目: 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )

A. O2在电极b上发生还原反应
B. 溶液中OH-向电极a移动
C. 反应消耗的NH3与O2的物质的量之比为4∶5
D. 负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】新能源汽车的核心部 件是锂离子电池,磷酸亚铁锂(LiFePO4)以其高倍率性、高比能量、高循环特征、高安全性、低成本、环保等优点而逐渐成为“能源新宠”。
[方法一]高温固相法是磷酸亚铁锂生产的主要方法。通常以亚铁盐(如FeC2O42H2O)磷酸盐和锂盐为原料,充分混匀后,在惰性气氛的保护气中先经过较低温预分解,再经过高温焙烧,研磨粉碎制成。其反应原理如下:
Li2CO3+2FeC2O42H2O+2NH4H2PO4 =2NH3↑+3CO2↑+ + +
(1)完成上述化学方程式______。
(2)理论上,反应中每转移0.15mol电子,会生成 ______gLiFePO4。
[方法二]以铁红、锂辉石LiAl(SiO3)2(含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂。其主要工艺流程如图:
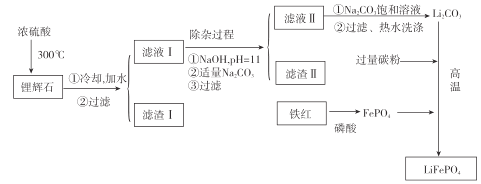
已知:2LiAl(SiO3)2+H2SO4(浓)![]() Li2SO4 + Al2O34SiO2H2O↓
Li2SO4 + Al2O34SiO2H2O↓
温度/℃ | 20 | 40 | 60 | 80 |
溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.5 |
(1)向滤液II中加入饱和Na2CO3溶液,过滤后 ,用“热水洗涤”的原因是_____。
(2)滤渣II的主要成分是_______(填化学式)。
(3)写出在高温下生成磷酸亚铁锂的化学方程式:_____________。
(4)工业上,将 Li2CO3粗品制备成高纯 Li2CO3 的部分工艺如下:
①将粗产品Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择半透膜隔开,用惰性电极电解,阳极的电极反应式是____________。
②电解后向产品LiOH 溶液中加入过量 NH4 HCO3并加热,过滤、烘干得高纯 Li2CO3。 请写出生成Li2CO3的化学方程式:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】尿素在农业、医药等诸多领域应用广泛。工业上有多种工艺用NH3和CO2直接合成尿素。
(1)水溶液全循环法合成尿素的反应过程可用下列热化学方程式表示:
反应I 2NH3(1) +CO2(g)NH2 COONH4(1) △H1 = - 119.2 kJmol-1
反应II NH2COONH4(1)CO(NH2)2(1)+ H2O(1) △H2= 15.5 kJmol-1
①写出NH3(1)与CO2(g)反应生成CO(NH2)2(1)和液态水的热化学方程式:______。
②该工艺要求在190~ 200℃、13 ~ 24 MPa 的条件下反应,90℃左右反应可实现最高平衡转化率。试解释选择高压条件的理由:_________。
(2)在不同氨碳比L=![]() 和水碳比W=
和水碳比W=![]() 条件下CO2平衡转化率x随温度T变化情况如图所示:
条件下CO2平衡转化率x随温度T变化情况如图所示:

①CO2平衡转化率x随温度T升高先增大后减小,试分析原因:_________。
②在图中,画出L=4、W=O时CO2平衡转化率x随温度T变化的曲线示意图____。
(3)实验室模拟热气循环法合成尿素,T℃度时,将5.6mol NH3与5.2molCO2在容积恒定为0.5L的恒温密闭容器中发生反应:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O (g) △H1=—43kJmol-1。达到平衡状态时,NH3与CO2的平衡分压之比 p(NH3): p(CO2)= 2:13。[p(NH3)= x(NH3)p,x(NH3)为平衡体系中NH3的物质的量分数,p为平衡总压]。
①T ℃时,该反应的平衡常数 K = ______________。
②若不考虑副反应,对于该反应体系,下列说法正确的是 _________ 。
A.当反应体系中气体分子的平均摩尔质量保持不变时,反应达到平衡状态
B.相同条件下,提高水碳比或降低氨碳比都会使NH3 的平衡转化率降低
C.在容器中加入CaO,(可与 H2O反应),提高CO(NH2)2产率
D.反应开始后的一段时间内,适当升温可提高单位时间内CO2的转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】化锡(SnI4)是一种橙黄色结晶,熔点为 144.5℃,沸点为364℃,不溶于冷水,溶于醇、苯、氯仿、四氯化碳等,遇水易水解,常用作分析试剂和有机合成试剂。实验室制备四氯化锡的主要步骤如下:
步骤1:将一定量锡、碘和四氯化碳加入干燥的烧瓶中,烧瓶上安装如图装置Ⅰ和Ⅱ。

步骤2:缓慢加热烧瓶,待反应停止后,取下冷凝管,趁热迅速进行过滤除去未反应的锡。用热的四氯化碳洗涤漏斗上的残留物,合并滤液和洗液,用冰水浴冷却,减压过滤分离。
步骤3:滤下的母液蒸发浓缩后冷却,再回收晶体。
请回答下列问题
(1)图中装置II的仪器名称为___________,该装置的主要作用是____________。
(2)减压过滤的操作有①将含晶体的溶液倒入漏斗,②将滤纸放入漏斗并用水润湿,③微开水龙头,④开大水龙头,⑤关闭水龙头,⑥拆下橡皮管。正确的顺序是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列装置应用于实验室制二氧化硫并验证其漂白性的实验,其中能达到实验目的的是

A.用装置甲制取二氧化硫
B.用装置乙收集二氧化硫
C.用装置丙验证二氧化硫的漂白性
D.用装置丁吸收二氧化硫
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究某无结晶水的正盐X(仅含有两种短周期元素)的组成和性质,设计并完成下列实验。(气体体积已转化为标准状况下的体积)
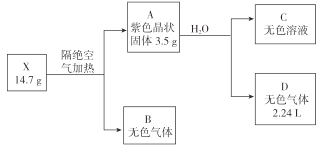
已知:B是空气的主要成分之一;C是一种强碱,且微溶于水 ,载人宇宙飞船内常用含 C的过滤网吸收宇航员呼出的CO2,以净化空气;D遇湿润的红色石蕊试纸变蓝。
(1)X的化学式为 __________________ 。
(2)图中B的组成元素在元素周期表中的位置是______________。
(3)A的电子式为 ____________。
(4)X受热分解转变成 A 和 B 的化学反应方程式为 ____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com