
科目: 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)![]() Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e﹣=Mn2O3(s)+2OH﹣(aq)
C. 电池工作时,电子由正极通过外电路流向负极
D. 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目: 来源: 题型:
【题目】在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题:
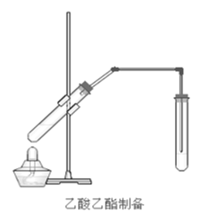
(1)写出制取乙酸乙酯的化学反应方程式________
(2)浓硫酸的作用是:①________;②________。
(3)饱和碳酸钠溶液的主要作用是________、________、________。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中的目的是防止________。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是________。
(6)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】于固定体积的密闭容器中进行的气体反应A(g)+B(g) ![]() C(s)+2D(g),可以说明在恒温下已达到平衡状态的是
C(s)+2D(g),可以说明在恒温下已达到平衡状态的是
①反应容器中压强不随时间变化而变化 ②A气体和B气体的生成速率相等 ③混合气体的平均摩尔质量不随时间变化而变化 ④反应混合气体的密度不随时间变化而变化
A. ③④B. ②③C. ①③D. ①④
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应2A(g)+3B(g) ![]() 2c(g)+D(g)在四种不同条件下的反应速率分别为( )。
2c(g)+D(g)在四种不同条件下的反应速率分别为( )。
①v(A)=0.5 mol/(L·min) ②v(B)=0.6 mol/(L·min)
③v(C)=0.35 mol/(L·min) ④v(D)=0.4 mol/(L·min)
则该反应在不同条件下反应速率最快的是( )
A.① B.② C.③ D.④
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( )
A. 2H+(aq) +![]() (aq)+
(aq)+![]() (aq)+2OH
(aq)+2OH![]() (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H![]() O(l);
O(l);![]() H=
H=![]() 57.3 kJ/mol
57.3 kJ/mol
B. KOH(aq)+![]() H
H![]() SO4(aq)=
SO4(aq)=![]() K
K![]() SO4(aq)+H
SO4(aq)+H![]() O(l);
O(l);![]() H=
H=![]() 57.3kJ/mol
57.3kJ/mol
C. C8H18(l)+![]() O
O![]() (g)=8CO
(g)=8CO![]() (g)+ 9H
(g)+ 9H![]() O;
O;![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
D. 2C8H18(g)+25O![]() (g)=16CO
(g)=16CO![]() (g)+18H
(g)+18H![]() O(l);
O(l);![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物H是合成药物盐酸沙格雷酯的重要中间体,其合成路线如图:
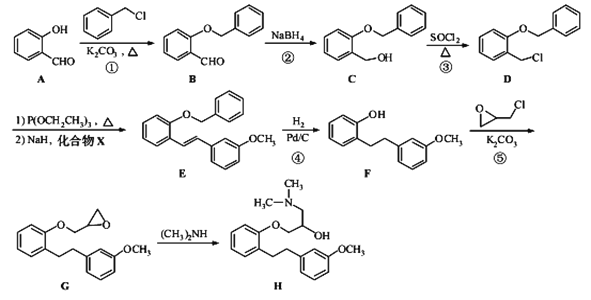
(1)化合物A中的含氧官能团为___和___(填官能团名称)。
(2)反应⑤的反应类型是___,反应方程式___。
(3)B的分子式___,1molB与足量的银氨溶液反应,最多能产生___gAg。
(4)检验D中卤原子种类,所需的试剂有___。
(5)写出同时满足下列条件的B的一种同分异构体的结构简式:___。
a.分子中含有两个苯环;
b.分子中有7种不同化学环境的氢;
c.不能与FeCl3溶液发生显色反应,但水解产物之一能发生此反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学实验室需要0.2 mol·L-1的NaOH溶液450 mL和0.5 mol·L-1的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题:
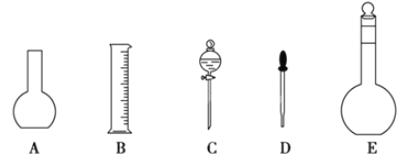
(1)如图所示的仪器中配制溶液肯定不需要的是__(填序号),配制上述溶液还需用到的玻璃仪器是__(填仪器名称)。
(2)容量瓶是配制溶液的主要仪器,容量瓶上标有以下六项中的__(填写序号)。
①温度 ②浓度 ③容量 ④压强 ⑤酸式或碱式 ⑥刻度线
(3)配制时,其正确的操作顺序是__(用字母表示,每个字母只能用一次)。
A 用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B 准确称取计算好的氢氧化钠固体于烧杯中,再加入少量水(约50 mL),用玻璃棒慢慢搅动,使其充分溶解,冷却到室温
C 将容量瓶盖紧,摇匀
D 将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中
E 改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F 继续往容量瓶内小心加水,直到液面接近刻度1~2 cm处
(4)根据计算,配制上述NaOH溶液需 NaOH固体的质量为__g。
(5)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:A(分子式为:C2H4)是来自石油的重要有机化工原料,B、D是厨房中的两种有机物,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。
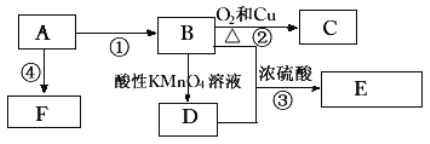
(1)A的电子式为________,官能团为:________;C的名称________,E的分子式为:________。
(2)B分子中的官能团名称是________,D分子中的官能团名称是________.
(3)写出下列反应的化学方程式并指出反应类型:
①________,反应类型________。
②________,反应类型________。
④________,反应类型________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究发现,铝元素能损害人的脑细胞。适当地补充碘元素可预防甲状腺肿大,但摄入过多也会导致甲状腺肿大,因此补充人体所需的元素时也要适可而止。试回答下列问题:
(1)Fe也是人体需要补充的元素之一,试写出Fe2+的核外电子排布式:________。
(2)与Al同一周期的Na、Mg元素也是人体所需元素,Na、Mg、Al基态原子第一电离能的大小关系是________。
(3)氯化铝的熔点是194℃,氧化铝的熔点是2054℃,但是工业上不能用电解熔融氯化铝的方法获取铝单质,这是因为________________________________________。
(4)F与I是同一主族的元素,BeF2与H2O都是由三个原子构成的共价化合物分子,二者分子中的中心原子Be和O的杂化方式分别为________、________,BeF2分子的立体构型是________,H2O分子的立体构型是________。
(5)I2晶体的晶胞结构如图所示,该晶胞中含有________个I2分子,设该晶胞的晶胞参数为acm,则I2的密度是________________g·cm-3。

查看答案和解析>>
科目: 来源: 题型:
【题目】现有常温下甲、乙、丙三种溶液,甲为0.1mol·L-1的NaOH溶液,乙为0.1mol·L-1的HCl溶液,丙为0.1mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=___。
(2)丙溶液中存在的电离平衡为___(用电离平衡方程式表示)。
(3)常温下,用水稀释0.1mol·L-1的CH3COOH溶液,下列各量随水量的增加而增大的是___(填序号)。
①n(H+) ②c(H+) ③![]() ④c(OH-)
④c(OH-)
(4)甲、乙、丙三种溶液中由水电离出的c(OH-)最大的是___。
(5)某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,得到如图所示的两条滴定曲线,则a=___。
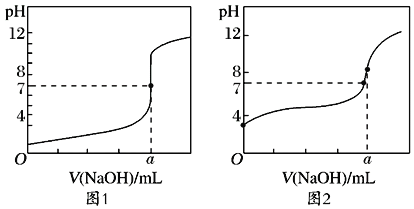
(6)图___(填1或2)表示NaOH溶液滴定CH3COOH溶液的过程。
(7)图2中a点对应的溶液pH=8,原因是___(用离子方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com