
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 100g 46%的乙醇溶液中,含H-O键的数目为7NA
B. pH=1的H3PO4溶液中,含有0.1NA个H+
C. 0.1mol Fe在足量氧气中燃烧,转移电子数为0.3NA
D. 1L 0.1mol·L-1的NH4Cl溶液中含有NH4+数目为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
①氯化钠饱和溶液![]()
![]() NaHCO3(s)
NaHCO3(s)
② Al2O3![]() AlCl3(aq)
AlCl3(aq)![]() Al(OH)3
Al(OH)3
③海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2(aq)
MgCl2(aq)![]() MgCl2(s)
MgCl2(s)
④N2![]() NO2
NO2![]() HNO3
HNO3
⑤重晶石(BaSO4)![]() BaCO3
BaCO3![]() BaCl2(aq)
BaCl2(aq)
A. ①③⑤ B. ②③④
C. ②④⑤ D. ①②⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如图所示。下列说法不正确的是

A.通过该催化反应,实现了太阳能向化学能的转化
B.反应I中涉及到非极性键的断裂和极性键的形成
C.反应II为:2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D.总反应为:2H2O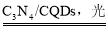 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】钼元素为人体及动植物必须的微量元素,也在钢铁工业中有着重要的作用,钼作为钢的合金化元素,可以提高钢的强度,特别是高温强度和韧性。我国钼元素的储量丰富,在世界上占第二位。如图所示是钼元素的相关信息,下列有关钼的说法错误的是
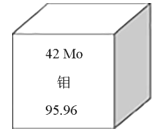
A.95Mo18O42-(钼酸根离子)中共计有76个电子
B.Mo元素是第五周期的主族元素
C.92Mo、95Mo、98Mo互为同位素,化学性质几乎相同
D.98Mo的原子核内中子数比质子数多14
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来,我国大力弘扬中华优秀传统文化,体现了中华民族的“文化自信”。下列有关说法错误的是( )
A.成语“百炼成钢”“蜡炬成灰”中均包含了化学变化
B.诗句“折戟沉沙铁未销”中的金属在常温下能溶于浓硝酸
C.谚语“雷雨肥庄稼”,其过程中包含了氧化还原反应
D.制备“陶冶新平肇汉唐,宋明瓷夺宝珠光”中的瓷,主要原料为黏土
查看答案和解析>>
科目: 来源: 题型:
【题目】某课题组采取以下路线合成利胆药——柳胺酚。
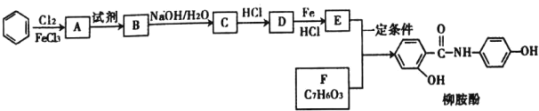
回答下列问题:
已知: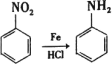
(1)对于柳胺酚,下列说法正确的是______________
A 有三种官能团 B 遇三氯化铁溶液显紫色
C 分子组成为C13H9NO3 D 1mol柳胺酚最多与3mol NaOH反应
(2)F的命名为______________;B中含氧官能团的名称为_________。
(3)写出化合物D的结构简式________________。
(4)写出E和F制取柳胺酚的化学反应方程式______________。
(5)写出同时符合下列条件的F的所有同分异构体的结构简式_______。
①能发生银镜反应 ②分子有四种不同化学环境的氢原子
(6)4-甲氧基乙酰苯胺是重要的精细化工中间体,写出由苯甲醚(![]() )制备4-甲氧基乙酰苯胺(
)制备4-甲氧基乙酰苯胺(![]() )的合成路线(注明试剂和条件)______。
)的合成路线(注明试剂和条件)______。
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸亚铬[(CH3COO)2Cr·H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:

(1)仪器a的名称是___________。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为_______。
②同时c中有气体产生,该气体的作用是______。
(3)打开K3,关闭K1和K2。c中亮蓝色溶液流入d,其原因是_______;
(4)指出装置d可能存在的缺点________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有部分短周期元素的原子结构如下表:
元素 编号 | 元素原子结构 |
X | 原子结构示意图为 |
Y | 最外层电子数是次外层电子数的2倍 |
Z | 原子核内含有12个中子,且其离子的结构示意图为 |
(1)写出X的元素名称:________,元素Y的最简单氢化物的结构式为___________;
(2)Z元素原子的质量数为________;
(3)X和Z两种元素的简单离子,离子半径大的是________(填离子符号),X和Z两种元素的最高价氧化物对应的水化物相互反应的离子方程式为_____________;
(4)Y和Z两种元素的最高价氧化物发生氧化还原反应的化学方程式为_________________,若反应过程中转移电子数为6.02×1023,则消耗Y的最高价氧化物的质量为__________;
(5)写出Z2O2的电子式______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙酸锰可用于制造钠离子电池的负极材料。可用如下反应制得乙酸锰: 4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH。
(1)Mn3+基态价层电子排布图为________。
(2)Mn(NO3)2·6H2O中非金属元素第一电离能从大到小的顺序__________。从电子云重叠的方式看N中存在的化学键类型有__________。
(3)与NO2-互为等电子体的一种分子的化学式为________。
(4)1molCH3COOH中含有的σ键数目为___________。CH3COOH分子通过氢键形成环状二聚物,写出含氢键表示的环状二聚物的结构简式___________。
(5)镁铝合金经过高温淬火获得一种储钠材料,其晶胞为立方结构(如图所示),图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为_________。镁铝合金密度为ρg/cm3,则该晶胞的边长为__________nm(阿伏加德罗常数的值为N)。
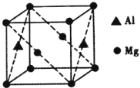
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学课外兴趣小组为探究足量的铜跟浓硫酸的反应情况,用下图所示装置进行有关实验。
已知:①SO2难溶于饱和亚硫酸氢钠溶液。②SO2能与酸性高锰酸钾溶液发生氧化还原反应。请回答下列问题:
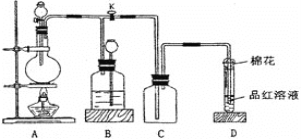
(1)装置A中发生的化学反应方程式为____________;此反应表明浓硫酸具有_________(填字母)。
a. 酸性 b. 脱水性 c. 强氧化性 d. 吸水性
(2)装置D中试管口放置的棉花中浸入__________溶液,其作用是_____________。
(3)装置B的作用是贮存多余的气体,B中应放置的液体是__________(填字母)。
a. 水 b. 饱和NaHSO3溶液 c. 酸性KMnO4溶液 d. NaOH溶液
(4)实验中,取一定质量的铜片和一定体积18.4 mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是____________。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是___________(填字母)。
a. 银粉 b. 铁粉 c. BaCl2溶液 d. NaHCO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com