
科目: 来源: 题型:
【题目】二氧化硫是常见的有刺激性气味的硫氧化物,是大气主要污染物之一。某学习兴趣小组设计如下所示装置制取SO2并探究其性质。

(1)仪器a的名称是________,装置B中观察到的现象是________。
(2)装置C中氯水褪色,证明SO2具有________(填“氧化性”“还原性”或“漂白性”)。
(3)装置D中出现淡黄色沉淀,发生反应的化学方程式为________。
(4)某同学认为在A、B间应增加F装置,该装置的作用是________。
(5)装置E能否证明SO2是酸性氧化物________(填“能”或“不能”),理由是________。
(6)硫的氧化物是形成酸雨的主要物质之一。某小组采集酸雨样品,每隔一段时间测定一次样品pH,得数据如下:
时间 | 开始 | 8h | 16h | 24h | 32h | 40h | 48h |
pH | 5.0 | 4.8 | 4.6 | 4.3 | 4.2 | 4.0 | 4.0 |
酸雨样品pH变小的主要原因是________(用发生反应的化学方程式解释)。某同学在48h后偶然测得样品的pH又减小到3.9,导致样品pH再次减小的原因可能是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )

A. Mg 电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH 增大
D. 溶液中Cl-向正极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要使用1.0mol/LNaOH溶液80mL。
(1)配制该NaOH溶液所需容量瓶的规格是________。
(2)用托盘天平称取NaOH固体________g。
(3)称量完成后,进行如下操作:
A.将称好的NaOH固体放在烧杯中,用适量蒸馏水溶解。
B.待固体全部溶解后,将溶液立即转移到容量瓶。
C.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液也都用玻璃棒引流注入容量瓶,轻轻摇动容量瓶,使溶液混合均匀。
D.继续向容量瓶加蒸馏水至液面离容量瓶颈刻度线下________cm时,改用_________滴加蒸馏水至溶液的凹液面与刻度线相切。
E.盖好瓶塞,反复上下颠倒,摇匀。
上述操作不正确的是________(填序号)。
(4)若未进行上述操作C,则所得溶液浓度________(填“偏高”“偏低”或“无影响”,下同)。若定容时如下图操作,则所得溶液浓度________。
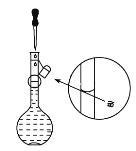
(5)取上述溶液10mL稀释至50mL,所得NaOH溶液的物质的量浓度为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】阅读下列科普材料并填空。
燃料电池是一种化学电池,具有能量转化率高、对环境友好等优点。例如,氢氧燃料电池在工作时,从负极连续通人①H2,从正极连续通入②O2,二者在电池内部(含有③H2SO4,或④KOH等物质的溶液)发生反应生成⑤H2O,同时产生电能。⑥CH4、⑦C2H5OH等也可以作为燃料电池的燃料。目前还研制成功⑧Al-⑨空气燃料电池,它可以代替汽油为汽车提供动力也可以用作照明电源等。
(1)上述材料涉及到的物质中,属于氧化物的是________(填序号,下同),属于混合物是________。
(2)从物质的类别来看,H2、O2、A1都属于________,包含以上三种物质所含元素的一种两性物质与NaOH溶液反应的离子方程式为________。
(3)已知甲烷燃料电池中发生反应为CH4+2O2=CO2+2H2O,标准状况下每消耗11.2L甲烷,转移的电子数目为________NA。
(4)上述燃料电池发生的反应均为________反应(填“氧化还原”或“非氧化还原”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】碘在医药卫生、高纯度金属提炼、光学仪器等领域起着至关重要的作用。从含碘化钾废液(可能还含有I2、IO3-)中回收I2,实验过程如下:
(1)确定碘的存在形式
①I2的确定:取含碘废液放入试管,加入CCl4,振荡静置,现象为_____,确定含有I2。
②IO3-的确定:取①中上层溶液,加入少量新配制的0.1mo/LFeSO4溶液,它的作用是____。振荡使之充分反应,再加入少量CCl4,CCl4层无紫色出现,说明该含碘废液中无IO3-。
(2)碘的回收
在含碘废液中加入适量的K2Cr2O7溶液和稀H2SO4,充分反应后经减压过滤得到粗碘,由粗碘提纯精制碘的装置如图:
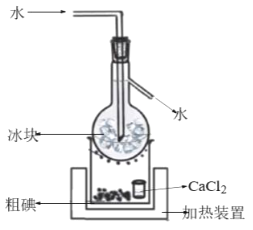
①补全得到粗碘的离子方程式:______。
□Cr2O72-+□I-+□ =□ +□Cr3++□ 。
②CaCl2的作用是__。
(3)碘的纯度分析(已知:2S2O32-+I2=2I-+S4O62-)
精确量取0.1136g精制后的碘置于250mL碘量瓶中,加入0.5gKI和30mL水,振荡至完全溶解(KI仅用于溶解)。以0.0513mol·L-1的Na2S2O3溶液快速滴定至淡黄色,加入1mL左右淀粉溶液,缓慢滴定至____,消耗Na2S2O3溶液17.26mL。碘的纯度的计算表达式为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜锌原电池(如图)工作时,下列叙述错误的是( )

A. 正极反应为:Cu2++2e–= Cu
B. 电池反应为:Zn+Cu2+=Zn2+ +Cu
C. 在外电路中,电子从负极流向正极
D. 盐桥中的K+移向ZnSO4溶液
查看答案和解析>>
科目: 来源: 题型:
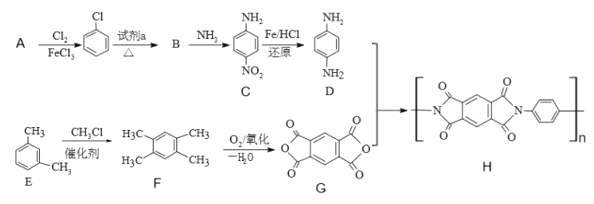
【题目】2019年,嫦娥四号成功在月球着陆。探测器上的五星红旗由一类特殊的聚酰亚胺(化合物H)制成。以下是H的合成路线:
已知: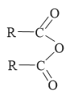 +R’—NH2
+R’—NH2![]() +RCOOH
+RCOOH
(1)A结构简式是____。
(2)试剂a是_____。
(3)B→C的反应类型______;C中含有的官能团名称为_____。
(4)写出D+G→H的化学反应方程式_____。
(5)写出一种苯环上一氯代物有三种,核磁共振氢谱为6:4:2:1:1的F的同分异构体的结构简式_____。(不考虑立体异构)
(6)设计由CH3CH2OH、![]() 合成
合成 的合成路线_____。(其它物质自选)。
的合成路线_____。(其它物质自选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】铅具有优秀的机械加工性能,可以制备各种性能优良的合金。广泛用于电池制造、机械、船舶工业、以及放射性防护等领域。
(1)铅的主要矿藏形式是方铅矿(PbS)利用其冶炼铅的反应过程如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H=akJ·mol-1
PbS(s)+2O2(g)=PbSO4(s) △H=bkJ·mol-1
PbS(s)+2PbO(s)=3Pb(s)+SO2(g) △H=ckJ·mol-1
则利用方铅矿和铅矾矿(主要成分为PbSO4)冶炼铅并生产一种可能造成酸雨的气体的热化学方程式为____。
(2)铅也可以采用热还原法冶炼:PbO(s)+CO(g)![]() Pb(s)+CO2(g) △H=dkJ·mol-1,已知该反应的平衡常数和温度的关系如下表:
Pb(s)+CO2(g) △H=dkJ·mol-1,已知该反应的平衡常数和温度的关系如下表:
温度/℃ | 300 | 727 | 1227 |
K | 106.2 | 631 | 17.4 |
①d____0(填>、<或=)
②已知某温度下K=10,向密闭容器中加入足量的Pb和一定量的CO2平衡时,混合气体中CO的体积分数为____。
(3)新型液流式铅蓄电池以可溶的甲基磺酸铅为电解质,电池总反应:Pb+PbO2+4H+![]() 2Pb2++2H2O
2Pb2++2H2O
下列关于该电池的说法正确的是____。
a.充放电时,溶液中Pb2+浓度保持不变
b.放电时,溶液中H+向PbO2极区移动
c.放电时的负极反应式为:Pb-2e-=Pb2+
d.充电时的阳极反应式为:Pb2++4OH--2e-=PbO2+2H2O
(4)河流、湖泊中的铅污染日益被人们重视。已知常温下Pb元素在水中的各种存在形式物质的量分数α和溶液pH的关系如图所示:
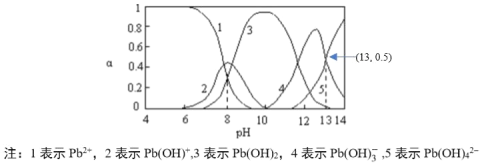
向醋酸铅溶液中逐滴滴加氢氧化钠溶液至pH=13时的主要离子反应方程式是_____,其平衡常数数值为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年诺贝尔奖授予JohnB.Goodenough等三位科学家,以表彰其在锂电池领域的贡献。磷酸亚铁锂(LiFePO4)用作锂离子电池正极材料,制备方法如图:

(1)制备水合磷酸铁(FePO4·xH2O)固体
①过程Ⅰ,加NaOH溶液调pH=2.0时透明混合溶液中含磷微粒主要是H2PO4-,过程Ⅰ发生的主要离子方程式是____。
②过程Ⅱ“氧化、沉淀”反应生成FePO4沉淀的离子方程式是____。
③进行过程III之前,需确认过程II中无Fe2+,检验试剂为____。
④FePO4·xH2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图:

水合磷酸铁的化学式为____。(x取整数)
(2)制备LiFePO4固体:
在氮气气氛保护下,高温焙烧FePO4、Li2CO3和过量葡萄糖的固体混合物。
①过量葡萄糖作用是____。
②锂离子电池在充电时,电极材料LiFePO4会迁出部分Li+,部分转变为Li(1-x)FePO4。此电极的电极反应为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述不正确的是
A.28gN2所含分子数为NA
B.0.2 mol/L Na2SO4中所含Na+ 数为0.4NA
C.标准状况下11.2L H2中所含原子数为NA
D.0.5mol CH4和1mol H2O中所含氢原子数均为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com