
科目: 来源: 题型:
【题目】某化学学习小组利用如图装置来制备无水AlCl3(已知:无水AlCl3遇水能迅速发生反应)。下列说法正确的是
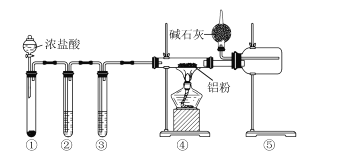
A.装置①中的试剂可能是二氧化锰
B.装置②、③中的试剂分别为浓硫酸、饱和食盐水
C.点燃④处酒精灯之前需排尽装置中的空气
D.球形干燥管中碱石灰的作用只有处理尾气
查看答案和解析>>
科目: 来源: 题型:
【题目】一种副作用小的新型镇痛消炎药K的合成路线如图所示:
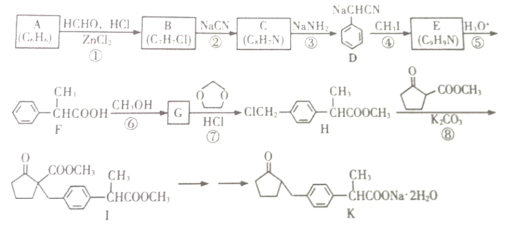
请回答下列问题
(1)F分子中官能团的名称为______________;B分子中处于同一平面的原子最多有____个
(2)反应⑥的条件为_______________;反应⑧的类型为_______________________。
(3)反应⑦除生成H外,另生成一种有机物的结构简式为_______________________。
(4)反应①的化学方程式为_______________________。
(5)符合下列条件的G的同分异构体有_____________种
Ⅰ.苯环上有且仅有四个取代基;
Ⅱ.苯环上的一氯代物只有一种;
Ⅲ.能发生银镜反应。
其中还能发生水解反应的同分异构体的结构简式为______________(只写一种即可)。
(6)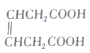 是合成
是合成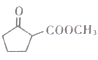 的重要中间体。参照题中合成路线,设计由1,3-丁二烯合成
的重要中间体。参照题中合成路线,设计由1,3-丁二烯合成![]() 的一种合成路线(无机试剂任选):_______________。
的一种合成路线(无机试剂任选):_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】钛酸锌(ZnTiO3)是一种抗菌涂料,应用于人造骨骼等生物移植技术。回答下列问题:
(1)基态Zn原子的电子占据能量最高的能层符号为_____________,与Zn同周期的所有副族元素的基态原子中,最外层电子数与Zn相同的元素有___________种
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性C____B(选填“>或“<”);第一电离能N>O,原因是__________________________________________。
(3)ZnTiO3与80%H2SO4反应可生成TiOSO4。
①![]() 的空间构型为_____________,其中硫原子采用____________杂化。
的空间构型为_____________,其中硫原子采用____________杂化。
②与![]() 互为等电子体的分子的化学式为_________________(任写一种即可)
互为等电子体的分子的化学式为_________________(任写一种即可)
(4)Zn与S所形成化合物晶体的晶胞如图所示。
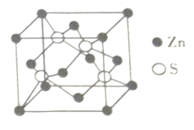
①与Zn原子距离最近的Zn原子有___________个。
②该化合物的化学式为_________________________________。
③已知该晶体的晶胞参数为a×10-12m,阿伏加德罗常数为NA。则该晶体的密度为__________________g/cm3(列式即可)
查看答案和解析>>
科目: 来源: 题型:
【题目】运用化学反应原理研究化学反应有重要意义。
(1)一氯胺(NH2Cl)是饮用水的二级消毒剂,水解生成一种具有强烈杀菌消毒作用的物质:
①NH2Cl中Cl元素的化合价为_____________。
②NH2Cl发生水解反应的化学方程式为_____________________________。
(2)SO2和CO均为燃煤产生的烟道气中有害成分,在催化作用下可利用二者相互反应进行无害化处理并回收硫。有关资料如图1所示。则:
①常温常压下,质量均为11.2g的CO(g)和S(s)分别完全燃烧生成CO2(g)或SO2(g),放出的热量前者比后者多________kJ。
②SO2(g)+2CO(g)=S(s)+2CO2(g) △H=___________________.
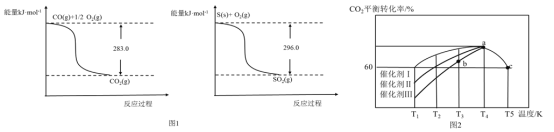
(3)在一定条件下,向恒容密闭容器中充入1.0molCO2和3.0molH2,在一定温度范围内发生如下转化:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-xkJ/mol x>0)。在不同催化剂作用下,相同时间内CO2的转化率随温度的变化如图2所示:
①催化效果最佳的是催化剂__________(选填“I”、“Ⅱ”或“Ⅲ”);b点v(正)___v(逆)(选填“>”、“<”或“=”)
②此反应在a点时已达到平衡状态,a点的转化率比c点高的原因是_____________
(4)常温下,H2CO3的电离常数为:Ka1=4×10-7,Ka2=4×10-11。已知0.1mol/LNH4HCO3溶液的pH=8,则在此溶液中:
①下列有关离子浓度的关系式中,不正确的是_____(填序号)
A.c(NH4+)>c(HCO3-)>c(OH-)>c(H+)
B.c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(H2CO3)
C.c(H2CO3)-c(CO32-)-c(NH3·H2O)=9.9×10-7mol·L-1
②![]() =________(结果保留三位有效数字)。
=________(结果保留三位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 在工业上可作蓄电池中良好的正极材料。以废铅蓄电池拆解出来的“铅泥”(主要成分为
在工业上可作蓄电池中良好的正极材料。以废铅蓄电池拆解出来的“铅泥”(主要成分为![]() ,另有少量Pb、
,另有少量Pb、![]() 和
和![]() 等)为原料制备
等)为原料制备![]() 的一种工艺流程如图所示:
的一种工艺流程如图所示:
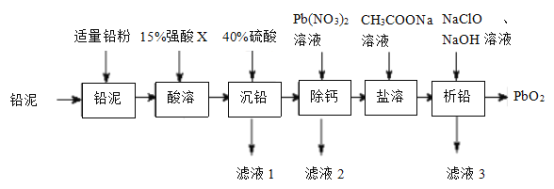
已知:i.常温下,单质铅与盐酸或硫酸几乎都不反应。
ii.铅盐中,(CH3COO)2Pb、Pb(NO3)2均易溶于水,![]() 难溶于水。
难溶于水。
请回答下列问题:
(1)“酸溶”时,Pb和PbO2转化为可溶性Pb2+盐,则“酸溶”时所用的强酸X为____;此条件下的氧化性:X___PbO2(选填“>”或“<”)
(2)用Pb(NO3)2溶液反复多次洗涤沉淀,以达到“除钙”的目的,其原理是_____________。
(3)(CH3COO)2Pb属于__________(选填“强电解质”或“弱电解质”);“滤液3”中除CH3COONa和NaClO外,所含钠盐主要还有___________(填化学式)
(4)“析铅”反应的离子方程式为____________________。
(5)从环境保护的角度分析,该工艺流程可能存在的缺点是_______________(任写一条)
(6)铅蓄电池中的电解液是H2SO4,放电后两个电极上均沉积有PbSO4。则放电时的负极反应式为___;充电时当电极上通过1mol电子,阳极的质量减少__________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】碘酸钾(![]() )是重要的微量元素碘添加剂。实验室设计下列实验流程制取并测定产品中
)是重要的微量元素碘添加剂。实验室设计下列实验流程制取并测定产品中![]() 的纯度:
的纯度:
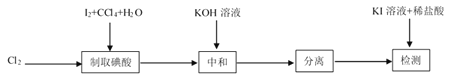
其中制取碘酸(![]() )的实验装置见图,有关物质的性质列于表中
)的实验装置见图,有关物质的性质列于表中
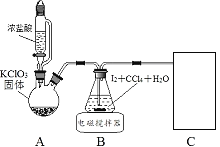
物质 | 性质 |
HIO3 | 白色固体,能溶于水,难溶于CCl4 |
KIO3 | ①白色固体,能溶于水,难溶于乙醇 ②碱性条件下易发生氧化反应:ClO-+IO3-=IO4-+Cl- |
回答下列问题
(1)装置A中参加反应的盐酸所表现的化学性质为______________。
(2)装置B中反应的化学方程式为___________________ 。B中所加CCl4的作用是_________从而加快反应速率。
(3)分离出B中制得的![]() 水溶液的操作为____________;中和之前,需将HIO3溶液煮沸至接近于无色,其目的是____________,避免降低
水溶液的操作为____________;中和之前,需将HIO3溶液煮沸至接近于无色,其目的是____________,避免降低![]() 的产率。
的产率。
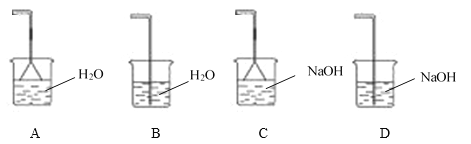
(4)为充分吸收尾气,保护环境,C处应选用最合适的实验装置是____________(填序号)。
(5)为促使![]() 晶体析出,应往中和所得的
晶体析出,应往中和所得的![]() 溶液中加入适量的___________。
溶液中加入适量的___________。
(6)取1.000g![]() 产品配成200.00mL溶液,每次精确量取20.00mL溶液置于锥形瓶中,加入足量KI溶液和稀盐酸,加入淀粉作指示剂,用0.1004mol/L
产品配成200.00mL溶液,每次精确量取20.00mL溶液置于锥形瓶中,加入足量KI溶液和稀盐酸,加入淀粉作指示剂,用0.1004mol/L![]() 溶液滴定。滴定至终点时蓝色消失(
溶液滴定。滴定至终点时蓝色消失(![]() ),测得每次平均消耗
),测得每次平均消耗![]() 溶液25.00mL。则产品中
溶液25.00mL。则产品中![]() 的质量分数为___(结果保留三位有效数字)。
的质量分数为___(结果保留三位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:还原性强弱:I- >Fe2+>Br-,向仅含Fe2+、I-、Br-的溶液中通入适量氯气,溶液中这三种离子的物质的量随消耗氯气物质的量的变化如图所示。下列说法中正确的是
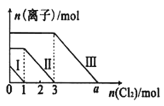
A.a值等于6
B.线段Ⅰ代表Br-的变化情况
C.线段Ⅲ代表Fe2+的变化情况
D.原混合溶液中n(FeBr2)=4mol
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常用氯氧化法处理含氰(CN-)废水,一定条件下,氯气和CN-反应生成无毒气体N2和CO2。下列说法不正确的是( )
A.CN-中碳元素的化合价为+2B.该反应的氧化产物是N2
C.反应中氧化剂和还原剂的系数比为5:2D.该反应的还原产物为Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组同学拟用如下装置制备纯净干燥的CO2,并与Na2O2样品反应(杂质不反应),通过测定量气管中氧气体积,计算出样品纯度(即质量分数)。

(1)A中装稀盐酸的仪器的名称是______________,B中的试剂a最好选用___________,E装置的作用____________________________。
(2)D装置中的现象为________________________;恢复到原温度后,读取F装置量气管刻度前必要的操作是___________________________________________________________。
(3)若无C装置,你认为对实验结果有何影响___________。(填“偏大”、“偏小”或“无影响”)。
(4)若取2.0gNa2O2样品充分反应后,F中收集到224mL氧气(折算成标准状况,不考虑氧气在水中的溶解),则样品纯度为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组对一含有Al3+的未知溶液进行了如下分析:(1)滴加少量NaOH溶液,无明显变化;(2)继续滴加NaOH溶液,有白色胶状沉淀生成;(3)滴加过量的NaOH溶液,白色胶状沉淀明显减少。实验小组经定量分析,得出如图所示沉淀的物质的量与滴加NaOH溶液体积的关系。下列说法错误的是( )

A. 该未知溶液中至少含有3种阳离子
B. NaOH溶液的物质的量浓度为5 mol·L-1
C. 若另一种离子为二价阳离子,则a=10
D. 若将最终沉淀过滤、洗涤、灼烧,其质量一定为6 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com