
科目: 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色气体,极易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)在处理废水时,ClO2可将废水中的CN-氧化成CO2和N2,该反应的离子方程式为_________。
(2)某小组通过NaClO3法制备ClO2,其实验装置如下图。
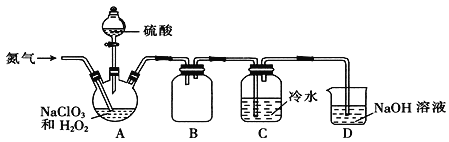
①通入氮气的主要作用有两个,一是可以起到搅拌作用,二是______________;
②装置B的作用是______________;
③装置A用于生成ClO2气体,该反应的化学方程式为______________;
④当看到装置C中导管液面上升时应进行的操作是______________。
(3)测定装置C中ClO2溶液的浓度:用______________(填仪器名称)取10.00 mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,用0.1000 mol·L-1的Na2S2O3标准液滴定至溶液呈淡黄色,发生反应:I2+2S2O32-=2I-+S4O62-,再加入__________作指示剂,继续滴定,当溶液_______,即为终点。平行滴定3次,标准液的平均用量为20.00 mL,则C中ClO2溶液的浓度为________mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是元素周期表的草图,表中所列字母代号分别代表某一种元素,请回答:

(1)表中最活泼的金属与最活泼的非金属形成的物质是___(填化学式)。
(2)由a、d两种元素可形成两种化合物,这两种化合物中都含的化学键有__(填字母)。
a.极性共价键 b.非极性共价键 c.离子键
(3)e、f、k、m对应的离子的半径由小到大的顺序为:___。
(4)d、e、m的最简单气态氢化物的稳定性由强到弱的顺序为:__。
(5)由m、n两种元素组成的常见化合物的电子式为:__。
(6)用电子式表示a与d形成的原子个数比1∶1的化合物的形成过程:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸(H2C2O4)是一种二元弱酸。常温下,向H2C2O4溶液中逐滴加入NaOH溶液,混合溶液中lgX[X为![]() 或
或 ]与pH的变化关系如图所示。下列说法一定正确的是
]与pH的变化关系如图所示。下列说法一定正确的是
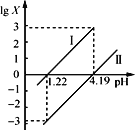
A.Ⅰ表示lg![]() 与pH的变化关系
与pH的变化关系
B.pH=1.22的溶液中:2c(C2O42-)+c(HC2O4-)=c(Na+)
C.根据图中数据计算可知,Ka2(H2C2O4)的数量级为10-4
D.pH 由1.22到4.19的过程中,水的电离程度先增大后减小
查看答案和解析>>
科目: 来源: 题型:
【题目】研究化学反应时,既要考虑物质变化与能量变化,又要关注反应的快慢与限度。回答下列问题:
(1)NH3还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图所示
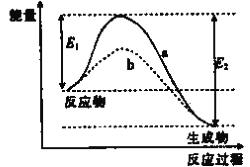
①上图中因为改变了反应条件,反应的活化能:b_______(填“>”“<"或“=”)a。
②脱硝反应的热化学方程式可表示为反应物→生成物△H=______(用E1、E2的代数式表示)。
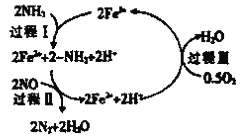
③研究发现,一定条件下的脱硝反应过程可能如图所示,根据氧化还原反应中物质的作用,NO为_______剂,脱硝总反应的化学方程式为_______________。
(2)一定温度下,将不同物质的量的H2O(g)和CO分别通入容积为1L的恒容密容器中,进行反应H2O(g)+CO(g)![]() CO2(g)+H2(g),得到如表所示的三组数据
CO2(g)+H2(g),得到如表所示的三组数据
试验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡时间/min | ||
H2O(g) | CO(g) | CO(g) | H2(g) | |||
1 | 650 | 2.0 | 4.0 | 3.0 | 1.0 | 5 |
2 | 900 | 1.0 | 2.0 | 1.8 | 0.2 | 4 |
3 | 900 | a | b | c | d | t |
①4mim内,实验2中v(CO2)=______; 900℃时,反应的平衡常数为______;降低温度时,平衡常数会________(填“增大”“减小”或“不变”)。
②650℃时,若在此容器中充入2.0 mol H2O(g)、1.0molCO(g)、1.0 mol CO2(g)和 xmol H2(g),要使反应在开始时向正反应方向进行,则x应满足的条件是__________。
若a=2.0.b=1.0,则平衡时实验2中H2O(g)和实验3中CO(g)的转化率(a)的关系为a(H2O) _______ (填“>”<”成=”)a(CO)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题:
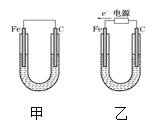
(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的___棒,乙装置中的____棒;
②乙装置的电化学防护法称为____,其中碳极的电极反应式是:_____。
③取少量甲装置中负极附近溶液加入2滴K3[Fe(CN)6]溶液,现象为___,发生反应的离子方程式为________
(2)若两装置中均为饱和NaCl溶液:
①写出乙装置中总反应的离子方程式:______。
②甲装置碳极的电极反应属于_____(填“氧化反应”或“还原反应”);
③将湿润的淀粉KI试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因_____
(3)用铂作电极电解饱和的下列物质的水溶液,一会儿后,向剩余电解液中加适量水,能使溶液和电解前相同的是(_____)
A.KI B.H2SO4 C.CuCl2 D.AgNO3
查看答案和解析>>
科目: 来源: 题型:
【题目】根据如图所示装置回答以下问题。

(1)利用如图装置可以验证元素非金属性的变化规律。图中D装置的名称是__,其作用是___。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2、Na2SO3、Na2CO3、H2O2、H2SO4,请选择合适药品设计实验验证氯的非金属性强于硫:装置B中发生反应的化学方程式为:__,装置C中发生的离子方程式为:__。
(3)若要用此装置证明非金属性:S>C>Si,从以下所给物质中选择药品设计实验:①稀盐酸②稀H2SO4③CaCO3④Na2CO3⑤Na2SiO3溶液⑥SiO2。试剂B与C分别为___(填序号);装置C中发生反应的离子方程式为:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各图均能表示甲烷的分子结构,按要求回答下列问题:
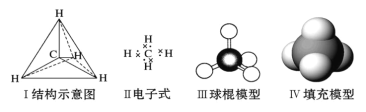
(1)下列事实能证明甲烷分子是正四面体结构,而不是平面结构的证据是___。
a.CH3Cl只有一种结构
b.CH2Cl2只有一种结构
c.CHCl3只有一种结构
d.CCl4只有一种结构
(2)1molCH4含__mol共用电子对,1mol某烷烃(CnH2n+2)含有__mol共用电子对。
(3)![]() 中共面的原子最多有__个。
中共面的原子最多有__个。
(4)某烷烃相对分子质量为58,其二氯代物有__种。
(5)若CH4、C2H6、C3H8、C4H10四种烃各为1g,在足量O2中燃烧,消耗O2最多的是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。如图为氢氧燃料电池的结构示意图,回答下列问题:

(1)O2进入的电极为___极。
(2)电池工作时:溶液中的OH-向___(填“正极”或“负极”)迁移,通__(填“H2”或“O2”)一极的电势较低。
(3)写出电池工作时的负极反应式:___。
(4)若电池工作时转移0.01mol电子,理论上消耗标准状态下__mLO2。
(5)若将此燃料电池改成以CH4和O2为原料进行工作时,负极反应式为:__。
查看答案和解析>>
科目: 来源: 题型:
【题目】符合分子式“C6H6”的多种可能结构如图所示,下列说法正确的是( )
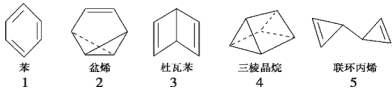
A.1~5对应的结构中所有原子均可能处于同一平面的有1个
B.1~5对应的结构中一氯取代物只有一种的有2个
C.1~5对应的结构中能使溴的四氯化碳溶液褪色的有4个
D.1~5对应的结构均能与氢气在一定条件下发生加成反应
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+H2O(g)=CO2(g)+H2(g)ΔH<0,在低温下获得高转化率与高反应速率。反应过程示意图如图:

下列说法正确的是( )
A.过程Ⅰ、过程Ⅱ均为放热过程
B.图示显示:起始时的2个H2O都参与了反应
C.过程Ⅲ生成了极性键和非极性键
D.使用催化剂降低了水煤气变换反应的ΔH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com