
科目: 来源: 题型:
【题目】下列有关实验室制取气体的反应中,其反应不属于氧化还原反应的是( )
A.实验室中用稀硫酸与Mg反应制取H2B.实验室中用高锰酸钾加热分解制取O2
C.实验室中用H2O2与MnO2作用产生O2D.实验室中用稀盐酸与石灰石反应制取CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】某浓度的氨水中存在下列平衡:NH3·H2O![]() NH4++OH-,若想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
NH4++OH-,若想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
A. 适当升高温度B. 加入NaCl固体C. 加入少量盐酸D. 通入NH3
查看答案和解析>>
科目: 来源: 题型:
【题目】如图装置(I)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学方程式为:2K2S2+KI3![]() K2S4+3KI。装置(II)为电解池的示意图。当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是( )
K2S4+3KI。装置(II)为电解池的示意图。当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是( )
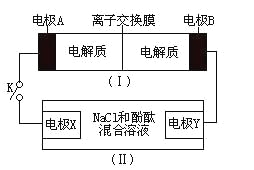
A.K+从右到左通过离子交换膜
B.电极A上发生的反应为:3I--2e-=I3-
C.电极X上发生的反应为:2Cl--2e-=C12↑
D.当有0.1molK+通过离子交换膜,X电极上产生1.12L气体(标准状况)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质在水溶液中的电离方程式正确的是
A. NaHCO3:NaHCO3![]() HCO3-+ Na+
HCO3-+ Na+
B. NaHSO4:NaHSO4=Na+ +HSO4-
C. CH3COONH4:CH3COONH4=NH4++CH3COO-
D. Fe(OH)3:Fe(OH)3![]() Fe(OH)2++2OH-
Fe(OH)2++2OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】有甲、乙、丙三种溶液,进行如下操作:则甲、乙、丙三种溶液可能是( )
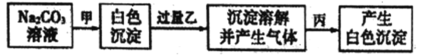
A.BaCl2、H2SO4、MgCl2B.BaCl2、HCl、Na2SO4
C.CaCl2、HNO3、NaClD.CaCl2、HNO3、BaCl2
查看答案和解析>>
科目: 来源: 题型:
【题目】环保部门检测到某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,要求该工厂从该废水中回收硫酸亚铁和金属铜。该工厂设计了如下流程图,完成回收硫酸亚铁和铜的简单实验方案。
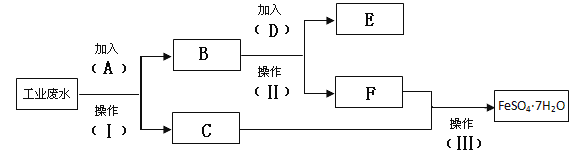
回答下列问题
(1)填写试剂A的化学式 _______________
(2)假如加入2mol D刚好完全反应,此步转移的电子的物质的量为 __________
(3)写出加入A的离子方程式: _________________
(4)操作Ⅱ和III 的名称分别是 ___________、 ____________、________
查看答案和解析>>
科目: 来源: 题型:
【题目】
G是功能高分子材料。以甲苯为原料合成G的一种流程如下(部分条件和产物略去)。
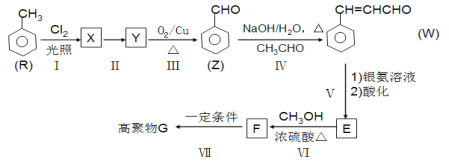
回答下列问题:
(1)W中官能团名称是:_______________________;反应Ⅰ的类型是_________________。
(2)反应Ⅱ的试剂和条件是____________、_______________;Z的名称是______________。
(3)写出F→G的化学方程式:_________________。
(4)T是E的同分异构体,T的苯环上有3个互不相同的取代基,T的结构有______种。
(5)W分子中最多有______个原子共平面。
(6)以乙醇为原料,经过三步合成正丁醇。参照上述流程图设计合成路线。___________
查看答案和解析>>
科目: 来源: 题型:
【题目】相同温度下,分别在起始体积均为1L的两个密闭容器中发生反应:X2(g)+3Y2(g)![]() 2XY3(g) △H=-akJ/mol 实验测得反应的有关数据如下表。
2XY3(g) △H=-akJ/mol 实验测得反应的有关数据如下表。
容器 | 反应条件 | 起始物质的量/mol | 达到平衡所用时间 /min | 达到平衡过程中的能量变化 | ||
X2 | Y2 | XY3 | ||||
① | 恒容 | 1 | 3 | 0 | 10 | 放热0.1akJ |
② | 恒压 | 1 | 3 | 0 | t | 放热bkJ |
下列叙述正确的是
A. 对于上述反应,①、②中反应的平衡常数K的数值不同
B. ①中:从开始至10min内的平均反应速率υ(X2)=0.1mol/(L·min)
C. ②中:X2的平衡转化率小于10%
D. b>0.1a
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种高效净水剂。已知:K2FeO4易溶于水,其溶液呈紫色、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。某小组同学用下图装置制备并探究K2FeO4的性质。制备原理:3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,装置如图所示(夹持装置略)。
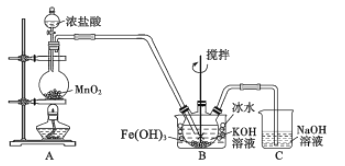
(1)盛放二氧化锰的仪器名称___________________,装置C的作用是____________________。
(2)装置A 中反应的化学方程式是________________________________________。
(3)实验时采用冰水浴的原因是________________,此装置存在一处明显缺陷,请指出___________。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,一般用75%乙醇进行洗涤,其目的是_________。
(5)查阅资料知,K2FeO4能将 Mn2+氧化成 MnO4-。该小组设计如下实验进行验证:
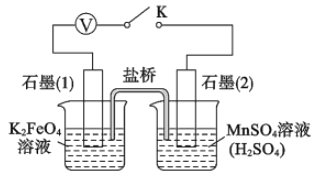
关闭K,左烧杯溶液变黄色,右烧杯溶液变紫色。检验左侧烧杯溶液呈黄色的原因,需要的试剂是_______;写出上图中负极的电极反应式: _________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,回答下列问题:
主族周期 | I A | II A | III A | IV A | V A | VI A | VII A | 0族 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ |
(1)元素①的名称是______;元素②在周期表中所处位置________。
(2)元素②的简单氢化物的结构式为________;
(3)用电子式表示元素⑤与⑦的化合物的形成过程:__________________。
(4)表示④与⑨按原子个数比1:1形成的化合物的电子式:______,该化合物中含有的化学键的类型______。
(6)④、⑥、⑦、⑨四种元素形成的简单离子,离子半径由大到小的顺序是_____(请用离子符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com