
科目: 来源: 题型:
【题目】如图所示实验装置用于测定气体摩尔体积,相关叙述正确的是( )
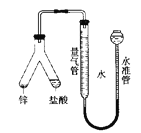
A. 用CCl4代替水,测得氢气的体积更准确
B. 量气管压入漏斗的水过多而溢出,会导致测定失败
C. 必须待体系温度降低到0℃时才可进行读数
D. 上提水准管,量气管液面高度不断改变,说明装置漏气
查看答案和解析>>
科目: 来源: 题型:
【题目】利用甲醇(CH3OH)制备一些高附加值产品,是目前研究的热点。
(1)甲醇和水蒸气经催化重整可制得氢气,反应主要过程如下:
反应Ⅰ. CH3OH(g)+H2O(g)![]() 3H2(g)+CO2(g) △H1
3H2(g)+CO2(g) △H1
反应Ⅱ. H2(g)+CO2(g)![]() H2O(g)+CO(g) △H2= a kJ·mol-1
H2O(g)+CO(g) △H2= a kJ·mol-1
反应Ⅲ. CH3OH(g)![]() 2H2(g)+CO(g) △H3= b kJ·mol-1
2H2(g)+CO(g) △H3= b kJ·mol-1
反应Ⅳ. 2CH3OH(g)![]() 2H2O(g)+C2H4(g) △H4= c kJ·mol-1
2H2O(g)+C2H4(g) △H4= c kJ·mol-1
①△H1=______kJ·mol-1 。
②工业上采用CaO吸附增强制氢的方法,可以有效提高反应Ⅰ氢气的产率,如图1,请分析加入CaO提高氢气产率的原因:______。
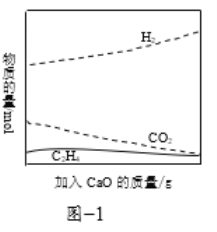
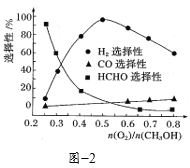
③在一定条件下用氧气催化氧化甲醇制氢气,原料气中![]() 对反应的选择性影响如题图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制
对反应的选择性影响如题图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制![]() =______,当
=______,当![]() = 0.25时,CH3OH和O2发生的主要反应方程式为______。
= 0.25时,CH3OH和O2发生的主要反应方程式为______。
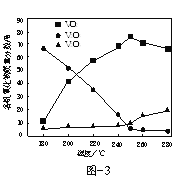
(2)以V2O5为原料,采用微波辅热-甲醇还原法可制备VO2,在微波功率1000kW下,取相同质量的反应物放入反应釜中,改变反应温度,保持反应时间为90min,反应温度对各钒氧化物质量分数的影响曲线如图3所示,温度高于250℃时,VO2的质量分数下降的原因是______。
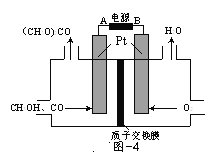
(3)以甲醇为原料,可以通过电化学方法合成碳酸二甲酯[(CH3O)2CO],工作原理如图4所示。
①电源的负极为______(填“A”或“B”)。
②阳极的电极反应式为______。
查看答案和解析>>
科目: 来源: 题型:
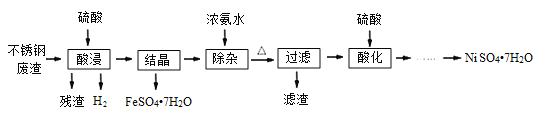
【题目】硫酸镍是电镀工业必不可少的化工原料。从不锈钢废渣(主要含Fe42.35%、Cr9.67%、Ni5.1%、C4.7%、Si3.39%等)中制取硫酸镍晶体的工艺流程如图:
 已知:①Cr3+与氨水反应时有少量Cr3+生成[Cr(NH3)6]3+,但加热时该络合物易分解。Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,用硫酸酸化时生成相应的硫酸盐。
已知:①Cr3+与氨水反应时有少量Cr3+生成[Cr(NH3)6]3+,但加热时该络合物易分解。Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,用硫酸酸化时生成相应的硫酸盐。
②Na2CrO4溶液中加酸调节pH为3.5时,CrO42-转化为Cr2O72-。
③相关物质在不同温度时溶解度如下表:
温度 溶解度/g 物质 | 20℃ | 30℃ | 40℃ | 60℃ | 80℃ | 90℃ |
Na2SO4 | 19.5 | 40.8 | 48.8 | 45.3 | 43.7 | 42.7 |
Na2Cr2O7 | 183 | 198 | 215 | 269 | 376 | 405 |
(1)“酸浸”后得到的溶液中主要含有FeSO4、NiSO4、Cr2(SO4)3,生成NiSO4的化学方程式为___。“酸浸”时需控制温度为90℃左右,可以采用的加热方式是___。
(2)“过滤”前,适当加热的目的是___。
(3)对“过滤”所得的滤渣进行洗涤,检验滤渣已洗涤干净的方法是___。
(4)“过滤”时产生的滤渣可用于制备Na2Cr2O7晶体。
①滤渣经干燥后与Na2CO3混合在空气中煅烧生成Na2CrO4和CO2,此反应的化学方程式为___。
②请补充完整上述煅烧后混合物制备Na2Cr2O7晶体(橙红色)的实验方案:水浸,过滤,___,烘干得Na2Cr2O7晶体(必须使用的试剂有:硫酸,蒸馏水)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知酸性:H2SO3>H2CO3>HSO![]() >HCO
>HCO![]() ,某无色溶液Y中可能含有以下几种离子:Cl-、SO
,某无色溶液Y中可能含有以下几种离子:Cl-、SO![]() 、HCO
、HCO![]() 、HSO
、HSO![]() 、Fe3+、Ba2+、NH
、Fe3+、Ba2+、NH![]() 、Na+,溶液中阳离子浓度相同,为了确定其组成,某课题小组进行如下实验(假设气体均全部逸出、忽略H2O2的分解)
、Na+,溶液中阳离子浓度相同,为了确定其组成,某课题小组进行如下实验(假设气体均全部逸出、忽略H2O2的分解)

下列说法不正确的是
A.溶液1中一定不存在Fe3+、SO![]()
B.气体1为CO2气体
C.溶液Y中一定含有Cl-,且n(Cl-)=0.01mol
D.溶液Y中可能存在Na+,可取溶液1通过焰色反应实验验证
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量Na2CO3、NaHCO3组成的混合物溶于水配成50 mL溶液,逐滴加入稀盐酸,得到各成分物质的量变化如图所示(忽略溶液混合导致的体积变化,已知1 mol=1000 mmol)。
下列说法不正确的是
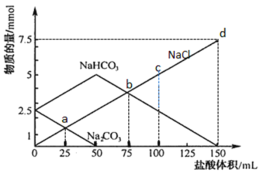
A.盐酸的物质的量浓度为0.05 mol·L-1
B.c点溶液中c(NaCl)=0.05 mol·L-1
C.a点溶液中发生反应的离子方程式为:CO![]() + H+ = HCO
+ H+ = HCO![]()
D.b点和d点所处的溶液中n(Na+)相等
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各选项能说明分子式为C4H6的烃是HC![]() C-CH2-CH3,而不是CH2=CH-CH=CH2的事实是( )
C-CH2-CH3,而不是CH2=CH-CH=CH2的事实是( )
A. 燃烧时有黑烟
B. 能使KMnO4酸性溶液褪色
C. 所有原子都在同一平面上
D. 与足量溴水反应,生成物中只有2个碳原子上有溴原子
查看答案和解析>>
科目: 来源: 题型:
【题目】不同条件下,用O2氧化a mol/L FeCl2溶液过程中所测的实验数据如图所示。
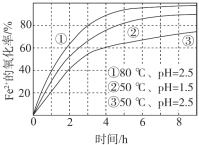
4Fe2+(aq)+4H+(aq)+O2(g)=4Fe3+(aq)+2H2O(l) ΔH>0
下列分析或推测合理的是
A.由①、②可知,pH越大,Fe2+越易被氧化
B.由②、③推测,若pH>7,Fe2+更难被氧化
C.pH=2.5、70℃时,0~3 h内Fe2+的平均消耗速率ν(Fe2+) < ![]() mol/(L·h)
mol/(L·h)
D.曲线②的变化趋势推测,反应吸热使得溶液温度下降,反应速率下降
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物(G)的合成路线如图:

已知:CH3(CH2)4Br![]() CH3(CH2)3CH2MgBr
CH3(CH2)3CH2MgBr
(1)G中所含的含氧官能团有___、___(写官能团名称)。
(2)C→D的反应类型是___;在空气中久置,A可由白色转变为橙黄色,其原因是___。
(3)写出符合下列条件的A的一种同分异构体的结构简式:___(只写一种)。
①能发生银镜反应,与FeCl3溶液能发生显色反应;②除苯环外,含有3种不同的官能团;③该分子核磁共振氢谱有5种不同的峰,且峰值比为1∶1∶2∶2∶2。
(4)写出以苯、乙醇、二甲基甲酰胺为原料制备苯丙酮(![]() )的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。___。
)的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于测定1mol氢气体积的操作中错误的是( )
A. 镁带称量后,用砂皮擦去表面的氧化层B. 保证装置不漏气
C. 用针筒注入硫酸后,拔出速度要快D. 镁带的质量要使产生的氢气足以计量
查看答案和解析>>
科目: 来源: 题型:
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如图:

已知:Ⅰ.铍、铝元素的化学性质相似,单质铍与氢氧化钠溶液反应生成可溶于水的Na2BeO2
Ⅱ.常温下部分难溶物的溶度积常数如下表:
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度积常数(Ksp) | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)滤液A的主要成分除NaOH外,还有___(填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式:___。
(2)滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为___(填字母)。
a.加入过量的氨水
b.通入过量的CO2
c.加入过量的NaOH
d.加入适量的HCl
e.洗涤
f.过滤
(3)①MnO2能将金属硫化物中的硫元素氧化为硫单质。写出反应Ⅱ中CuS发生反应的化学方程式:___。
②若用浓HNO3溶解金属硫化物,缺点是___(任写一条)。
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可将其依次分离,首先沉淀的是___(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于___。
(5)电解NaCl-BeCl2混合熔盐可制备金属铍,如图是电解装置图。
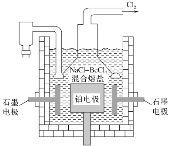
①石墨电极上的电极反应式为___。
②电解得到的Be蒸气中约含1%的Na蒸气,除去Be中少量Na的方法为___。
已知部分物质的熔、沸点如下表:
物质 | 熔点(K) | 沸点(K) |
Be | 1551 | 3243 |
Na | 370 | 1156 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com