
科目: 来源: 题型:
【题目】氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可如图表示。
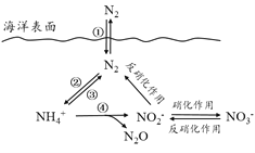
(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是__________(填图中数字序号)。
(2)下列关于海洋氮循环的说法正确的是_______(填字母序号)。
a.海洋中存在游离态的氮 b.海洋中的氮循环起始于氮的氧化c.海洋中的反硝化作用一定有氧气的参与d.向海洋排放含![]() 的废水会影响海洋中
的废水会影响海洋中![]() 的含量
的含量
(3)有氧时,在硝化细菌作用下,![]() 可实现过程④的转化,将过程④的离子方程式补充完整:___
可实现过程④的转化,将过程④的离子方程式补充完整:___![]() +5O2==2
+5O2==2![]() +____H++____+_____
+____H++____+_____
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式氯化铜为绿色或墨绿色结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中十分稳定。
Ⅰ.模拟制备碱式氯化铜。向![]() 溶液中通入
溶液中通入![]() 和
和![]() ,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。
,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。
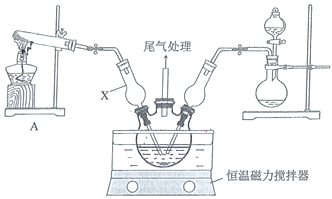
(1)仪器X的名称是________,其主要作用有导气、________。
(2)实验室利用装置A制![]() ,发生反应的化学方程式为________。
,发生反应的化学方程式为________。
(3)反应过程中,在三颈烧瓶内除观察到溶液蓝绿色褪去,还可能观察到的现象是________、________、________。
(4)若体系![]() 过高会导致碱式氯化铜的产量_______(填“偏高”、“偏低”或“无影响”)。
过高会导致碱式氯化铜的产量_______(填“偏高”、“偏低”或“无影响”)。
(5)反应结束后,将三颈瓶中的混合物过滤,从滤液中还可以获得的副产品是________(填化学式),经提纯得产品无水碱式氯化铜。
Ⅱ.无水碱式氯化铜组成的测定。称取产品![]() ,加硝酸溶解,并加水定容至200mL,得到待测液。
,加硝酸溶解,并加水定容至200mL,得到待测液。
(6)铜的测定:取20.00mL测液,经测定,![]() 浓为
浓为![]() 。则称取的样品中
。则称取的样品中![]() ________mol。
________mol。
(7)采用沉淀滴定法测定氯:用![]() 标准溶液滴定过量的
标准溶液滴定过量的![]() ,实验如图:
,实验如图:

①滴定时,应选用下列哪种物质作为指示剂________(填标号)。
A.![]() B.
B.![]() C.
C.![]()
②重复实验操作三次,消耗![]() 溶液的体积平均为10.00mL。则称取的样品中
溶液的体积平均为10.00mL。则称取的样品中![]() ______mol。
______mol。
(8)根据上述实验结果可推知无水碱式氯化铜的化学式为________。
查看答案和解析>>
科目: 来源: 题型:
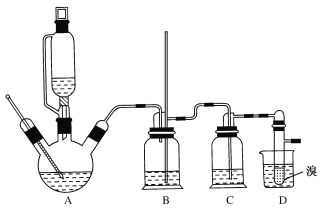
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,不溶于水,易溶于醇等有机溶剂。实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
已知:①乙醇在浓硫酸存在下在140℃脱水生成乙醚
2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
②实验中常因温度过高而使乙醇和浓硫酸反应生成少量SO2和CO2,用12.0g溴和足量的乙醇制备1,2-二溴乙烷,实验装置如图所示:
有关数据列表如下:
类别 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,A中按最佳体积比3﹕1加入乙醇与浓硫酸后,A中还要加入几粒碎瓷片,其作用是___。要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是___。
(2)装置B的作用是作安全瓶,瓶中盛水,除了可以防止倒吸以外,还可判断装置是否堵塞,若堵塞,B中现象是____。
(3)在装置C中应加入NaOH溶液,其目的是____。
(4)装置D中小试管内盛有液溴,判断该制备反应已经结束的最简单方法是___。
(5)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在___层(填“上”或“下”)。若产物中有少量未反应的Br2,最好用___洗涤除去;若产物中有少量副产物乙醚,可用____(填操作方法名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是___。
(7)若实验结束后得到9.4g产品,1,2—二溴乙烷的产率为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为周期表的一部分,表中所列的字母分别代表一种化学元素。
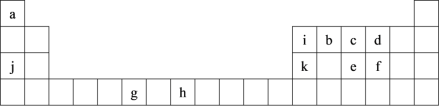
用化学用语回答下列问题:
(1)写出元素g的基态原子核外电子排布式______,h2+中未成对电子数为____。
(2)在b2a2分子中,元素b为__杂化,该分子是___分子(填“极性”或“非极性”),该分子中σ键和π键的数目比为____。
(3)bd2与bf2比较,沸点较高的是___(填分子式),原因是_______。
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙正确是___。
A h位于元素周期表中第四周期第VIII族,属于d区元素
B e的基态原子中,3p能级为半充满,属于p区元素
C 最外层电子排布式为4s2,一定属于IIA族
D 最外层电子排布式为ns2np1,该元素可能是ⅢA族或ⅢB族
(5)i元素最高价含氧酸是一元弱酸,它的水溶液之所以呈弱酸性并非本身能电离出H+,而是它加合了一个OH-,形成配位键,请用“→”表示);请用离子方程式表示____与ia4-互为等电子体的一种阳离是____,ia4-的空间构型为___。
(6)下表是一些气态原子逐级电离能(kJ·mol-1):

①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量___________
②表中X可能为以上元素中的____元素(填写元素符号)。Y与X的最高价氧化物的水化物溶液反应的离子方程式为______
查看答案和解析>>
科目: 来源: 题型:
【题目】在如图所示的恒温、恒压密闭容器中加入2mol X和2mol Y,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?) ![]() a Z(g)。起始时容器的体积为V L,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为V L。请回答下列问题:
a Z(g)。起始时容器的体积为V L,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为V L。请回答下列问题:

(1)a = _________________;
(2)平衡时Y的转化率=________________
(3)X的状态为______________,Y的状态为______________(填“气态”或“非气态”)
(4)下列叙述中,能说明上述反应达到平衡状态的是____________(填编号)
a.气体密度不变 b.单位时间内消耗2mol X,同时生成amol Z
c.Y的转化率不再变化 d.Z的浓度不再变化
e.气体的质量不随时间的变化而变化
查看答案和解析>>
科目: 来源: 题型:
【题目】采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题
(1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。该反应的氧化产物是一种气体,其分子式为___________。
(2)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
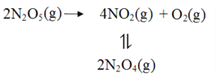
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O4(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5. | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
①已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1=4.4 kJ·mol1
2NO2(g)=N2O4(g) ΔH 2=55.3 kJ·mol1
则反应N2O5(g)=2NO2(g)+ ![]() O2(g)的ΔH=_______ kJ·mol1。
O2(g)的ΔH=_______ kJ·mol1。
②研究表明,N2O5(g)分解的反应速率![]() 。t=62 min时,测得体系中
。t=62 min时,测得体系中![]() pO2=2.9 kPa,则此时的
pO2=2.9 kPa,则此时的![]() =________kPa,v=_______kPa·min1。
=________kPa,v=_______kPa·min1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是________。
④25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5![]() NO2+NO3 快速平衡
NO2+NO3 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是_______(填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高
查看答案和解析>>
科目: 来源: 题型:
【题目】硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
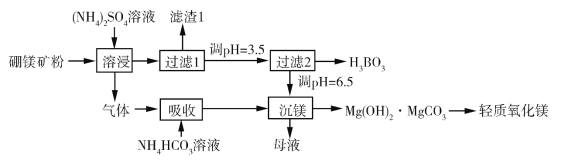
回答下列问题:
(1)在95 ℃“溶侵”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为_________。
(2)“滤渣1”的主要成分有_________。为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是_________。
(3)根据H3BO3的解离反应:H3BO3+H2O![]() H++B(OH)4,Ka=5.81×1010,可判断H3BO3是_______酸;在“过滤2”前,将溶液pH调节至3.5,目的是_______________。
H++B(OH)4,Ka=5.81×1010,可判断H3BO3是_______酸;在“过滤2”前,将溶液pH调节至3.5,目的是_______________。
(4)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为__________,母液经加热后可返回___________工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】分析、归纳、探究是学习化学的重要方法和手段之一。下面就电解质A回答有关问题(假定以下都是室温时的溶液)。
(1)电解质A的化学式为NanB,测得浓度为c mol/L的A溶液的pH=a。
①试说明HnB的酸性强弱____。
②当a=10时,A溶液呈碱性的原因是(用离子方程式表示)______。
③当a=10、n=1时,A溶液中各种离子浓度由大到小的顺序为____,(OH-)-c(HB)=______。
④当n=1、c=0.1、溶液中c(HB):c(B-)=1∶99时,A溶液的pH为___(保留整数值)。
(2)已知难溶电解质A的化学式为XnYm,相对分子质量为M,测得其饱和溶液的密度为ρg/cm3,Xm+离子的浓度为c mol/L,则该难溶物XnYm的溶度积常数为Ksp=___。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是
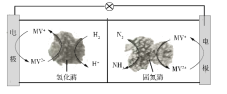
A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能
B. 阴极区,在氢化酶作用下发生反应H2+2MV2+![]() 2H++2MV+
2H++2MV+
C. 正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D. 电池工作时质子通过交换膜由负极区向正极区移动
查看答案和解析>>
科目: 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
请按要求回答下列问题:
(1)①~⑨九种元素中非金属性最强的是________(填元素符号)。
(2)元素⑧的原子结构示意图是_________;由①、④、⑥三种元素组成的化合物,其电子式是_________。
(3)元素②、⑧的气态氢化物的稳定性较强的是________________(填化学式);元素③、⑨的最高价氧化物对应的水化物的酸性较强的是________________(填化学式)。
(4)③、④span>、⑧三种元素的原子半径由大到小的顺序是________________(填元素符号)。
(5)元素⑤、⑥组成的化合物的化学键类型是________________________。
(6)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式是________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com