
科目: 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,反应如下:CO(g)+2H2(g)=CH3OH(g)。在2L密闭容器中充入物质的量之比为1:2的CO和H2,在催化剂作用下充分反应.测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如下图所示。下列说法正确的是

A.该反应的△H<O,且p1<p2<p3
B.在C点时,H2转化率为75%
C.反应速率:v逆(状态A)>v逆(状态B)
D.在恒温恒压条件下,向该密闭容器中再充入1molCH3OH,
达平衡时CH3OH的体积分数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】在2L密闭容器内,t℃时发生反应:N2(g)+3H2(g)![]() 2NH3(g),在体系中,n(N2)随时间的变化如下表:
2NH3(g),在体系中,n(N2)随时间的变化如下表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
N2的物质的量(mol) | 0.20 | 0.10 | 0.08 | 0.06 | 0.06 | 0.06 |
(1)上述反应在第5min时,N2的转化率为___;
(2)用H2表示从0~2min内该反应的平均速率v(H2)=___;
(3)t℃时,在4个均为2L密闭容器中不同投料下进行合成氨反应。根据在相同时间内测定的结果,判断该反应进行快慢的顺序为___。(用字母填空,下同);
a.v(NH3)=0.05mol·L-1·min-1
b.v(H2)=0.03mol·L-1·min-1
c.v(N2)=0.02mol·L-1·min-1
d.v(H2)=0.00lmol·L-1·s-1
(4)下列表述能作为反应达到化学平衡状态的标志是___。
a.反应速率v(N2)∶v(H2) ∶v(NH3)=1∶3∶2
b.各组分的物质的量浓度不再改变
c.混合气体的平均相对分子质量不再改变
d.混合气体的密度不变
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验中,对应的操作、现象及实验原理或结论均正确的是
实验目的 | 操作和现象 | 实验原理或结论 | |
A | 验证AgI和 AgCl的 Ksp大小 | 向1mL 1mol·L-1NaCl溶液中滴加2滴 2mol·L-1 AgNO3溶液,生成白色沉淀;再滴加 2滴1mol·L-1KI溶液,白色沉淀变成黄色沉淀 | AgCl(s)+I-(aq) |
B | 比较HClO和 HF溶液的酸性 | 室温下,用pH试纸分别测定浓度为0.1mol·L-1NaClO 溶液、0.1mol·L-1NaF 溶液的pH | 酸越弱,酸根离子水解程度越大,其盐溶液碱性越强 |
C | 提纯混有少量硝酸钾的氯化钠固体 | 在较高温度下制得浓溶液再冷却结晶、过滤、干燥 | 氯化钠溶解度随温度升高变化不大,而硝酸钾溶解度随温度升髙显著增大 |
D | 检验某溶液中是否含有CO32- | 先滴加盐酸产生气泡,将该气体通入澄清石灰水中,有白色沉淀生成 | 该溶液中一定含有CO32- |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】用活性炭还原法可以处理氮氧化物。某研究小组向2L密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ![]() N2(g)+CO2(g) △H<0。在T1℃时,反应进行到不同时间测得各物质的浓度(mol/L)如表所示,则下列说法不正确的是
N2(g)+CO2(g) △H<0。在T1℃时,反应进行到不同时间测得各物质的浓度(mol/L)如表所示,则下列说法不正确的是
时间/t(min) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
A. 10~20 min内,NO的平均反应速率为0.018mol/(Lmin)
B. T1℃时,该反应的平衡常数K=0.25
C. 保持与前30min的反应条件相同,再向容器中加入2molN2和2molNO,则平衡向左移动
D. 30min后,只改变了一个条件,根据上述表格判断,该条件可能为缩小容器体积
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,将 0.10 mol·L-1 盐酸滴入 20.00 mL 0.10 mol·L-1 氨水中,溶液中 pH 和 pOH 随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列正确的是

A. M 点所示溶液中可能存在c(Cl-)> c(NH4+)
B. N 点所示溶液中可能存在:c (NH4+)+ c(NH3﹒H2O)= c(Cl-)
C. Q 点盐酸与氨水恰好中和
D. M 点到Q点所示溶液中水的电离程度先变大后减小
查看答案和解析>>
科目: 来源: 题型:
【题目】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
A. x=1B. B的转化率为20%
C. 平衡时A的浓度为1.50 mol·L-1D. B的平均反应速率为0.2 mol·L-1·s-1
查看答案和解析>>
科目: 来源: 题型:
【题目】铁是人类应用较早,当前应用量最大的金属元素。下列有关说法中正确的是( )
A.人类使用铁制品在铝之后
B.常温下,铁不能与浓硝酸反应
C.铁与水蒸气在高温下的反应产物为Fe2O3和H2
D.除去FeCl3溶液中的FeCl2杂质可以向溶液中加入适量氯水
查看答案和解析>>
科目: 来源: 题型:
【题目】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:
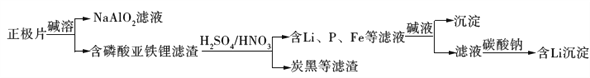
下列叙述错误的是
A. 合理处理废旧电池有利于保护环境和资源再利用
B. 从“正极片”中可回收的金属元素有Al、Fe、Li
C. “沉淀”反应的金属离子为Fe3+
D. 上述流程中可用硫酸钠代替碳酸钠
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下
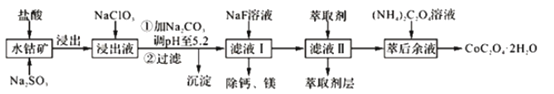
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)CoC2O4·2H2O中C的化合价是____________________________。
(2)写出浸出过程中Na2SO3与Co2O3发生反应的离子方程式:______________。
(3)浸出液中加入NaClO3的目的是____________________________。
(4)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除Al(OH)3外,还有的成分是______________(填化学式),试用离子方程式和必要的文字简述其原理:____________________________。
(5)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是______________;其使用的适宜pH范围是______________。
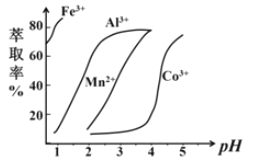
A. 2.02.5
B. 3.03.5
C. 4.04.5
(6)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀。己知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量 NaF后,所得滤液 c(Mg2+)/c(Ca2+) =______________。
(7)用m1kg水钴矿(含Co2O360%)制备CoC2O4·2H2O,最终得到产品m2kg,产率(实际产量/理论产量×100%)为____________________________。(已知:M(Co2O3)=166, M(CoC2O4·2H2O)=183,仅需列出数字计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图,是实验室制备乙酸乙酯的装置。a试管中加入3 mL 95%的乙醇、2 mL 浓硫酸、2 mL 冰醋酸;b试管中是饱和碳酸钠溶液。连接好装置,用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验。
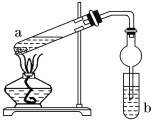
(1)在a试管中除了加入乙醇、浓硫酸和乙酸外,还应放入____________,目的是____________。
(2)试管b中观察到的主要现象是__________________________。
(3)实验中球形干燥管除起冷凝作用外,另一个重要作用是_________________。
(4)饱和Na2CO3溶液的作用是__________________________________________。
(5)反应结束后,将试管中收集到的产品倒入分液漏斗中,然后分液,得到乙酸乙酯。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com