
科目: 来源: 题型:
【题目】如图所示,装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图;装置(Ⅰ)的离子交换膜只允许![]() 通过。电池放电的化学方程式为
通过。电池放电的化学方程式为![]() 。当闭合K时,X极附近溶液先变红色。下列说法正确的是( )
。当闭合K时,X极附近溶液先变红色。下列说法正确的是( )
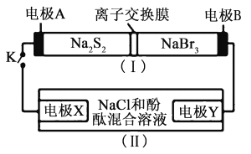
A.装置(Ⅰ)中A为正极
B.电极X的电极溶液变红的原因![]()
C.放电时,电极B的电极反应式为![]()
D.给原电池充电时![]() 从右向左通过离子交换膜
从右向左通过离子交换膜
查看答案和解析>>
科目: 来源: 题型:
【题目】根据实验操作及现象所得出的解释或结论不正确的是( )
选项 | 实验操作及现象 | 解释或结论 |
A. | 向某溶液中加入足量稀盐酸,无明显现象,再加入BaCl2溶液,有白色沉淀产生 | 该溶液中一定含有SO |
B. | 向某溶液中加入浓NaOH溶液,加热,产生 能使湿润的红色石蕊试纸变蓝的气体 | 该溶液中一定含有NH |
C. | 向某钾盐中滴加盐酸,产生使澄清石灰水变浑浊的无色无味气体 | 该钾盐是K2CO3或KHCO3 |
D. | 酸性硝酸铁溶液中加入几滴碘化钾淀粉溶液,出现蓝色 | 铁离子具有较强氧化性,将I-氧化生成I2 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列解释事实的离子方程式正确的是( )
A.用过量氨水除去烟气中的二氧化硫:SO2+NH3·H2O=![]() +
+![]()
B.过量的Fe和稀硝酸反应:Fe+4H++![]() =Fe3++NO↑+2H2O
=Fe3++NO↑+2H2O
C.稀硫酸与氢氧化钡溶液混合产生沉淀:Ba2++![]() =BaSO4↓
=BaSO4↓
D.实验室用MnO2和浓盐酸制Cl2:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物M只含C、H、O三种元素。取13.6g M在足量氧气中燃烧,生成35.2g CO2和7.2g H2O。在相同条件下,M的蒸气对氢气的相对密度为68。
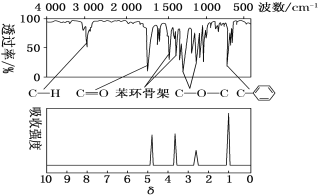
(1)通过计算确定M的分子式。(要求:写出解题过程)____________。
(2)经测定:M的红外光谱和核磁共振氢谱分别如下图所示,则M的结构简式为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,向2 L恒容密闭容器中充入1 mol A,发生2A(g)![]() B(g)+C(g)反应。反应过程中c(C)随时间变化的曲线如图所示,下列说法不正确的是( )
B(g)+C(g)反应。反应过程中c(C)随时间变化的曲线如图所示,下列说法不正确的是( )
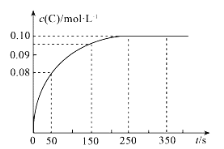
A.反应在0~50 s的平均速率v(C)=1.6×10-3molL-1s-1
B.该温度下,反应的平衡常数K=0.025 molL-1
C.保持其他条件不变,升高温度,平衡时c(B)=0.09 molL-1,则该反应的H<0
D.反应达平衡后,再向容器中充入1 mol A,该温度下再达到平衡时,A的转化率不变
查看答案和解析>>
科目: 来源: 题型:
【题目】CO与N2O是汽车尾气中污染大气的成分,研究表明CO与N2O在Fe+作用下生成无害气体,发生反应的能量变化及反应历程如图所示,两步反应分別为:① N2O+Fe+=N2+FeO+(慢);② FeO++CO=CO2+Fe+(快)。下列说法不正确的是( )
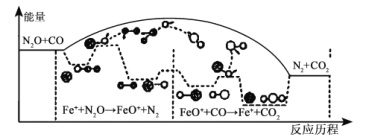
A.①是氧化还原反应,②不是氧化还原反应
B.两步反应均为放热反应,总反应的化学反应速率由反应①决定
C.Fe+使反应的活化能减小,增大反应速率
D.FeO+在该反应过程中作催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】防治污染要坚决打好蓝天、碧水、净土三大保卫战。某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
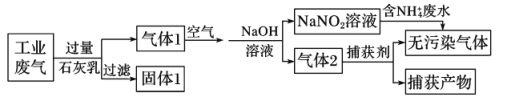
下列说法正确的是( )
A.固体1的成分是CaCO3、CaSO3
B.向气体1中通入的空气需要过量
C.捕获剂所捕获的气体主要是CO
D.处理含NH4+废水时,发生的反应为NH4++5NO2-+4H+=6NO↑+4H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】无水FeCl2是常用还原剂,实验室中可以利用反应2FeCl3+C6H5Cl![]() 2 FeCl2+ C6H4Cl2+HCl↑制取,已知:C6H5Cl熔点-45℃,沸点132℃;C6H4Cl2熔点53℃,沸点173℃。下列说法不正确的是( )
2 FeCl2+ C6H4Cl2+HCl↑制取,已知:C6H5Cl熔点-45℃,沸点132℃;C6H4Cl2熔点53℃,沸点173℃。下列说法不正确的是( )
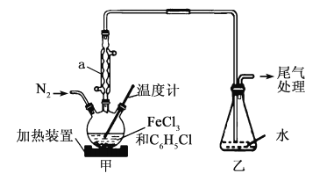
A.仪器a的作用是冷凝、回流、导气
B.反应开始前应向甲中通N2,为防止FeCl2被装置中空气氧化
C.反应结東后,甲中混合物经冷却、过滤、干燥得到纯净的产品
D.最好用油浴加热三颈烧瓶
查看答案和解析>>
科目: 来源: 题型:
【题目】1-溴丙烷是一种重要的有机合成中间体。实验室制备少量1-溴丙烷的主要步骤如下:
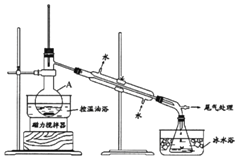
步骤1:在仪器A中加入搅拌磁子、12g 1-丙醇及20mL水,在冰水冷却下缓慢加入28mL浓H2SO4;冷却至室温,搅拌下加入24g NaBr。
步骤2:缓慢加热,直到无油状物馏出为止。
步骤3:将馏出液转入分液漏斗,分离出有机相。
步骤4:将分离出的有机相转入分液漏斗,依次用H2O、5%的Na2CO3溶液洗涤,分液,得粗产品,进一步提纯得1-溴丙烷。
已知:①1-溴丙烷沸点为71℃,密度为1.36g/cm3;
②反应过程中,在仪器A中可以观察到A的上方出现红棕色蒸气(Br2)。
回答下列问题:
(1)仪器A的名称是______;加入搅拌磁子的目的是搅拌和______。
(2)仪器A中主要发生反应为:NaBr + H2SO4===HBr + NaHSO4和______。
(3)步骤2中需向接收瓶内加入少量冰水并置于冰水浴中的目的是______,同时可以观察到的现象是______。
(4)步骤4中的两次洗涤,依次洗去的主要杂质是______、_________。
(5)步骤4中的Na2CO3溶液还可以用下列中的______试剂代替。
A.NaOH溶液 B.NaI溶液 C.Na2SO3溶液 D.CCl4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com