
科目: 来源: 题型:
【题目】甲、乙、丙三种物质均含有同一种中学常见元素X,其转化关系如下,下列说法不正确的是
![]()
A.若A为硝酸,X为金属元素,则甲与丙反应可生成乙
B.若乙为NaHCO3,则丙一定是CO2
C.若A为NaOH溶液,X为短周期的金属元素,则乙一定为白色沉淀
D.若A为金属单质,乙的水溶液遇KSCN溶液变红,则甲可能为非金属单质
查看答案和解析>>
科目: 来源: 题型:
【题目】写出下列有机物的系统命名或结构简式:
(1) ![]() _________________
_________________
(2)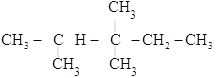 ________________
________________
(3)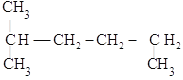 __________
__________
(4)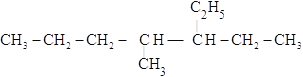 ______________
______________
(5)2,2-二甲基-3-乙基己烷____________________
(6)1,1,2,2-四氯丙烷____________________
查看答案和解析>>
科目: 来源: 题型:
【题目】甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质。下列各图均能表示甲烷的分子结构,按要求回答下列问题。
A.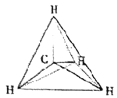 B.
B. C.
C. D.
D.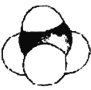
(1)甲烷的球棍模型是____________
(2)甲烷与丙烷互为____________
A.同位素 B.同素异形体 C.同系物 D.同分异构体。
(3)某研究小组为了探究甲烷和氯气反应的情况,设计了以下实验。
[实验一]用如图所示装置,试管中是甲烷和氯气的混合气体,光照后观察实验现象,回答以下问题。

①该反应的反应类型为_________。
②该反应的化学方程式为(只写第一步)_________。
③该实验的实验现象为____________、____________、试管壁上出现油状液滴。
④若题目中甲烷与氯气体积之比为1∶1,则得到的产物为____________(填字母,下同)。
A.![]() 、
、![]()
B.![]() 、
、![]()
C.![]() 、
、![]()
D.![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
[实验二]实验一光照一段时间后,往水槽中滴加![]() 溶液,看到有白色沉淀生成,认为甲烷与氯气反应有氯化氢生成。
溶液,看到有白色沉淀生成,认为甲烷与氯气反应有氯化氢生成。
⑤你认为该实验设计得出的结论是否正确?若不正确,回答理由_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)有BaCl2和KCl的混合溶液V L,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀,消耗a mol H2SO4;另一份滴加AgNO3溶液,消耗b mol AgNO3使Cl-完全沉淀。原混合溶液中的K+的物质的量浓度为___mol·L-1。
(2)一定条件下,PbO2与Cr3+反应,产物是![]() 和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为____mol;
和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为____mol;
(3)在一定条件下,实验室分别以过氧化氢、高锰酸钾、氯酸钾、过氧化钠为原料制取氧气,当制得同温同压下相同体积的氧气时,四个反应中转移的电子数之比为___________。
(4)自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用Al粉还原NO3-,产物是N2。发生的反应可表示如下,请完成方程式的配平。Al+NO3-+ —AlO2-+N2↑+H2O,_____________
(5)某化学反应的反应物和产物:KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
①该反应的氧化产物是__________。
②若该反应方程式中I2和KIO3的计量数分别是是6和3,请在下边的化学式上用单线桥标出电子转移的方向和数目:KMnO4+KI+H2SO4→__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D为石墨电极,E、F分别为短周期相邻的两种活泼金属中的一种,且E能与NaOH溶液反应。按图接通线路,反应一段时间,当电路中通过1.0×10-3mol电子时,下列叙述正确的是( )
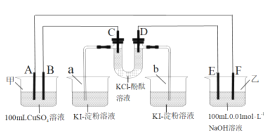
A.U型管中的D端先变红,b烧杯中的溶液会变蓝
B.a烧杯中最多有0.127gI2(KI足量)生成,甲池中的质量会减少0.04g(CuSO4溶液足量)
C.A极产生气体的体积为5.6mL,甲池溶液的pH值为2
D.E电极附近的溶液无明显现象产生
查看答案和解析>>
科目: 来源: 题型:
【题目】正己烷是优良的有机溶剂,其球棍模型为![]() ,下列有关说法正确的是( )
,下列有关说法正确的是( )
A.正己烷的分子式为![]()
B.正己烷的一氯代物有3种
C.正己烷能与溴发生取代反应而使溴水褪色
D.主链上含有4个碳原子的正己烷的同分异构体只有1种
查看答案和解析>>
科目: 来源: 题型:
【题目】纯碱是一种非常重要的化工原料,在玻璃、肥料、合成洗涤剂等工业中有着广泛的应用。
(1)工业上“侯氏制碱法”以NaCl、NH3、CO2及水等为原料制备纯碱,其反应原理为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。生产纯碱的工艺流程示意图如下:
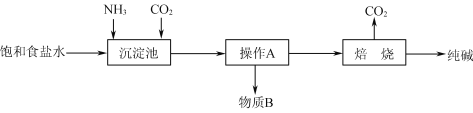
请回答下列问题:
①析出的NaHCO3晶体中可能含有少量氯离子杂质,检验该晶体中是否含有氯离子杂质的操作方法是________。
②该工艺流程中可回收再利用的物质是________________。
③若制得的纯碱中只含有杂质NaCl。测定该纯碱的纯度,下列方案中可行的是________(填字母)。
a. 向m克纯碱样品中加入足量CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为b g
b. 向m克纯碱样品中加入足量稀盐酸,用碱石灰(主要成分是CaO和NaOH)吸收产生的气体,碱石灰增重b g
c. 向m克纯碱样品中加入足量AgNO3溶液,产生的沉淀经过滤、洗涤、干燥,称其质量为b g
(2)将0.84 g NaHCO3和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.10 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是___________(填字母)。
A.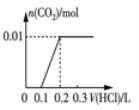 B.
B.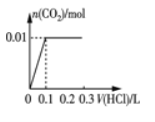
C.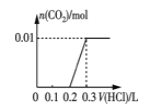 D.
D.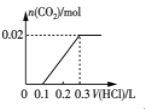
(3)若称取10.5 g纯净的NaHCO3固体,加热一段时间后,剩余固体的质量为8.02 g。如果把剩余的固体全部加入到100 mL 2 mol·L-1的盐酸中充分反应。求溶液中剩余的盐酸的物质的量浓度(设溶液的体积变化及盐酸的挥发忽略不计)___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向10mL0.2mol·L-1的KIO3溶液中逐渐加入NaHSO3粉末,生成的I2的物质的量随所加NaHSO3的物质的量变化如图所示,下列说法不正确的是( )
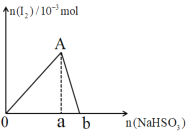
A.A点对应的I2的物质的量为1.0×10-3mol
B.0a:ab=5:1
C.当溶液中的n(I2)=5×10-4mol时,加入NaHSO3的物质的量可能为2.5×10-3mol或4.5×10-3mol
D.由ab段反应可知,氧化性I2>HSO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】银锌纽扣电池如图,电池反应式为:![]() ,下列说法正确的是( )
,下列说法正确的是( )
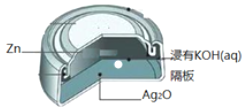
A.锌作负极
B.电池工作时,电流从Zn经导线流向Ag2O
C.正极发生还原反应
D.负极的电极反应式为:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学利用原电池装置探究物质的性质。资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 | 编号 | 电极A | 溶液B | 操作及现象 |
| Ⅰ | Fe | pH=2的H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是_____________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是_______;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是___________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性因素。
编号 | 溶液B | 操作及现象 |
Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是_____________。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究_____________________对O2氧化性的影响;实验Ⅳ中加入Na2SO4溶液的目的是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com